Với giải Bài 2 trang 32 Chuyên đề Hóa học 10 Chân trời sáng tạo chi tiết trong Bài 4: Entropy và biến thiên năng lượng tự do Gibbs giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Chuyên đề Hóa 10. Mời các bạn đón xem:
Giải bài tập Chuyên đề Hóa học 10 Bài 4: Entropy và biến thiên năng lượng tự do Gibbs
Bài 2 trang 32 Chuyên đề Hóa học 10: Em hãy dự đoán trong các phản ứng sau, phản ứng nào có ∆S > 0, ∆S < 0 và ∆S ≈ 0. Giải thích.
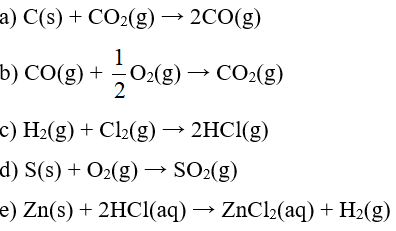
Lời giải:
- Các phản ứng hóa học làm tăng số mol khí thường có biến thiên entropy dương (∆S > 0).
- Các phản ứng hóa học làm giảm số mol khí thường có biến thiên entropy âm (∆S < 0)
- Các phản ứng hóa học không làm thay đổi số mol khí hoặc phản ứng không có chất khí sẽ có biến thiên entropy nhỏ (∆S ≈ 0)
a) Phản ứng làm tăng số mol khí ⇒ ∆S > 0
b) Phản ứng làm giảm số mol khí ⇒ ∆S < 0
c) Phản ứng có số mol khí trước và sau phản ứng bằng nhau ⇒ ∆S ≈ 0
d) Phản ứng có số mol khí trước và sau phản ứng bằng nhau ⇒ ∆S ≈ 0
e) Phản ứng làm tăng số mol khí ⇒ ∆S > 0
Xem thêm lời giải bài tập Chuyên đề Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 27 Chuyên đề Hóa học 10: Nếu một lọ nước hoa được mở, chúng ta sẽ ngửi được mùi thơm từ xa, do các phân tử của thành phần nước hoa khuếch tán vào không khí, đó là quá trình tự xảy ra. Ngược lại, để thu hồi các phân tử nước hoa đó vào trong lọ như trạng thái ban đầu thì không thể thực hiện được. Đó là quá trình không tự xảy ra. Các phản ứng hóa học cũng tương tự như vậy, có phản ứng tự xảy ra và có phản ứng không tự xảy ra. Các quá trình trong tự nhiên có xu hướng xảy ra theo chiều tăng độ mất trật tự (hỗn loạn) của các tiểu phân trong hệ, người ta gọi đó là quá trình tăng entropy. Nếu một lọ nước hoa được mở, chúng ta sẽ ngửi được mùi thơm từ xa??...
Câu hỏi 1 trang 27 Chuyên đề Hóa học 10: Tại sao khi tăng nhiệt độ lại làm tăng entropy của hệ?...
Câu hỏi 2 trang 28 Chuyên đề Hóa học 10: Khi chuyển thể của chất từ trạng thái rắn sang lỏng và khí thì entropy của chất tăng hay giảm? Giải thích...
Luyện tập trang 28 Chuyên đề Hóa học 10: Quan sát bình đựng Br2(l) đang bay hơi (a) và bình đựng I2(s) đang thăng hoa (b) trong hình bên và Quan sát bình đựng Br2(l) đang bay hơi (a) và bình đựng I2(s) đang thăng hoa ...
Luyện tập trang 29 Chuyên đề Hóa học 10: Dựa vào số liệu Bảng 4.1, hãy tính biến thiên entropy chuẩn của các phản ứng sau:...
Câu hỏi 3 trang 29 Chuyên đề Hóa học 10: Hòa tan vôi sống (CaO) vào nước, phản ứng tỏa nhiệt hay thu nhiệt? Dự đoán dấu ∆H của phản ứng...
Vận dụng trang 31 Chuyên đề Hóa học 10: Khi cho mẩu nhỏ sodium (Na) vào chậu thủy tinh chứa nước, mẩu sodium tan, có bọt khí xuất hiện, làm tăng nhiệt độ của nước trong chậu. Giải thích tại sao phản ứng này lại tự xảy ra một cách dễ dàng...
Bài 1 trang 32 Chuyên đề Hóa học 10: Quan sát hình dưới: Khi trộn nước và propanol (bên trái) thu được dung dịch (bên phải). Hãy cho biết quá trình đó sẽ làm tăng hay giảm entropy...
Bài 3 trang 32 Chuyên đề Hóa học 10: Cho phản ứng hóa học:...