Với giải Bài 1 trang 12 Chuyên đề Hóa học 10 Chân trời sáng tạo chi tiết trong Bài 1: Liên kết hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Chuyên đề Hóa 10. Mời các bạn đón xem:
Giải bài tập Chuyên đề Hóa học 10 Bài 1: Liên kết hóa học
Bài 1 trang 12 Chuyên đề Hóa học 10: Viết công thức Lewis của các phân tử sau:
a) HCN
b) SO3
Lời giải:
a) Viết công thức Lewis của HCN
Bước 1: C có 4 electron hóa trị, H có 1 electron hóa trị, N có 5 electron hóa trị.
⇒ Tổng số electron hóa trị là: 4 + 1 + 5 = 10 electron.
Bước 2: Sơ đồ khung biểu diễn liên kết của phân tử HCN
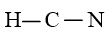
Bước 3: Số electron hóa trị chưa tham gia liên kết trong sơ đồ là: 10 – 2 × 2 = 6 electron
Hoàn thiện octet cho nguyên tử có độ âm điện lớn hơn trong sơ đồ:
Sử dụng 6 electron này để tạo octet cho N trước
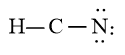
Bước 4: Đã sử dụng hết 6 electron để tạo octet cho N. Tuy nhiên C chưa đủ octet nên ta chuyển 2 cặp electron của nguyên tử N tạo thành cặp electron dùng chung giữa C và N. Nguyên tử H đã đủ octet
Vậy công thức Lewis của HCN là:
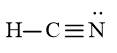
b) Viết công thức Lewis của SO3
Bước 1: S có 6 electron hóa trị, O có 6 electron hóa trị. Trong phân tử SO3, có 1 nguyên tử S và 3 nguyên tử O
⇒ Tổng số electron hóa trị là: 1.6 + 3.6 = 24 electron
Bước 2: Sơ đồ khung biểu diễn liên kết của phân tử SO3
S có độ âm điện nhỏ hơn nên S là nguyên tử trung tâm.
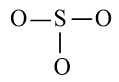
Bước 3: Số electron hóa trị chưa tham gia liên kết trong sơ đồ là: 24 – 2 × 3 = 18 electron
Hoàn thiện octet cho nguyên tử có độ âm điện lớn hơn trong sơ đồ:
Sử dụng 18 electron này để tạo octet cho O trước (vì O có độ âm điện cao hơn)
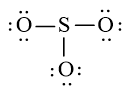
Bước 4: Đã sử dụng hết 18 electron để tạo octet cho O. Tuy nhiên S chưa đủ octet nên ta chuyển 1 cặp electron của nguyên tử O tạo thành cặp electron dùng chung.
Vậy công thức Lewis của SO3 là:
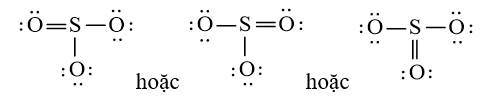
Xem thêm lời giải bài tập Chuyên đề Hóa học 10 Chân trời sáng tạo hay, chi tiết khác:
Mở đầu trang 5 Chuyên đề Hóa học 10: Hình học phân tử (hình dạng phân tử) của một chất rất quan trọng trong việc xác định cách thức phân tử chất đó tương tác và phản ứng với các phân tử khác. Hình học phân tử cũng ảnh hưởng đến nhiệt độ sôi và nhiệt độ nóng chảy của chất. Nhiều đặc tính của chất được giải thích từ dữ liệu hình học phân tử của nó...
Câu hỏi 1 trang 5 Chuyên đề Hóa học 10: Viết công thức Lewis của nguyên tử oxygen và nguyên tử magnesium...
Câu hỏi 2 trang 5 Chuyên đề Hóa học 10: Viết công thức electron của phân tử methane (CH4)...
Vận dụng trang 6 Chuyên đề học tập Hóa học 10: Khi dùng chlorine để khử trùng hồ bơi, chlorine sẽ phản ứng với urea trong nước tiểu và mồ hôi người tắm, tạo hợp chất nitrogen trichloride (NCl3), gây ra nhiều tác động xấu đến sức khỏe như đỏ mắt, hen suyễn, …
Câu hỏi 3 trang 6 Chuyên đề Hóa học 10: Hãy tính tổng số electron hóa trị của phân tử BF3...
Câu hỏi 4 trang 6 Chuyên đề Hóa học 10: Xác định nguyên tử trung tâm trong BF3. Lập sơ đồ khung của phân tử BF3...
Câu hỏi 5 trang 6 Chuyên đề Hóa học 10: Thực hiện Bước 3 cho phân tử BF3 và cho biết có cần tiếp tục bước 4?...
Luyện tập trang 7 Chuyên đề Hóa học 10: Viết công thức Lewis của phân tử CCl4...
Câu hỏi 6 trang 7 Chuyên đề Hóa học 10: Theo công thức Lewis của nước, phân tử nước có bao nhiêu cặp electron riêng ở nguyên tử trung tâm?...
Câu hỏi 7 trang 7 Chuyên đề Hóa học 10: Xác định giá trị n, m trong công thức VSEPR của phân tử SO2. Cho biết công thức Lewis của SO2 là...
Câu hỏi 8 trang 7 Chuyên đề Hóa học 10: Viết công thức VSEPR của H2O, NH3 và SO2...
Luyện tập trang 8 Chuyên đề Hóa học 10: Sử dụng mô hình VSEPR để dự đoán hình học của phân tử CS2...
Câu hỏi 9 trang 9 Chuyên đề Hóa học 10: Vì sao góc liên kết HCH trong phân tử methane không thể là 90o?...
Câu hỏi 10 trang 9 Chuyên đề Hóa học 10: Em có nhận xét gì về hình dạng, kích thước, năng lượng và hướng của các orbital nguyên tử lai hóa?...
Câu hỏi 11 trang 9 Chuyên đề Hóa học 10: Nếu tổng số các AO tham gia lai hóa là 3 sẽ tạo ra bao nhiêu AO lai hóa?...
Câu hỏi 12 trang 10 Chuyên đề Hóa học 10: Nguyên tử carbon trong phân tử CO2 ở trạng thái lai hóa nào? Giải thích liên kết hóa học tạo thành trong phân tử CO2 theo thuyết lai hóa...
Câu hỏi 13 trang 10 Chuyên đề Hóa học 10: Theo mô hình VSEPR, phân tử formaldehyde có dạng tam giác phẳng. Xác định trạng thái lai hóa của nguyên tử trung tâm carbon. Cho biết formaldehyde có công thức như hình sau đây:...
Câu hỏi 14 trang 11 Chuyên đề Hóa học 10: Tương tự như công thức VSEPR, có thể dự đoán nhanh trạng thái lai hóa của nguyên tử A (nguyên tố s, p) trong một phân tử bất kì như sau:...
Câu hỏi 15 trang 11 Chuyên đề Hóa học 10: Phân tử chứa nguyên tử lai hóa sp3 có cấu trúc phẳng không? Giải thích và cho ví dụ...
Luyện tập trang 12 Chuyên đề Hóa học 10: Biết nguyên tử oxygen trong phân tử H2O ở trạng thái lai hóa sp3. Trình bày sự hình thành liên kết hóa học trong phân tử H2O...
Bài 2 trang 12 Chuyên đề Hóa học 10: Viết công thức VSEPR và dự đoán hình học của các phân tử sau:...
Bài 3 trang 12 Chuyên đề Hóa học 10: Trình bày sự tạo thành liên kết hóa học trong các phân tử sau dựa vào sự lai hóa của các nguyên tử trung tâm:...
Bài 4 trang 12 Chuyên đề Hóa học 10: Dự đoán trạng thái lai hóa của nguyên tử trung tâm trong các phân tử sau:...