Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 8 Bài 44: Luyện tập chương 6 chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 8. Mời các bạn đón xem:
Giải SBT Hóa học 8 Bài 44: Luyện tập chương 6
Bài 44.1 trang 60 SBT Hóa học 8: Cân 10,6 g muối Na2CO3 cho vào cốc chia độ. Rót vào cốc khoảng vài chục mililít nước cất, khuấy cho muối tan hết. Sau đó rót thêm nước vào cốc cho đủ 200 ml. Ta được dung dịch Na2CO3 có khối lượng riêng là 1,05 g/ml. Hãy tính nồng độ phần trăm và nồng độ mol của dung dịch vừa pha chế.
Phương pháp giải:
Sử dụng các công thức:
Lời giải:
Nồng độ phần trăm của dung dịch pha chế:
- Khối lượng của dung dịch Na2CO3 :
- Nồng độ phần trăm của dung dịch
Nồng độ mol của dung dịch pha chế:
- Số mol Na2CO3 trong dung dịch:
- Nồng độ mol của dung dịch :
.
Bài 44.2 trang 60 SBT Hóa học 8: Có : CuSO4 và nước cất. Hãy tính toán và trình bày cách pha chế để có được những sản phẩm sau :
a) 50 ml dung dịch CuSO4 có nồng độ 1M.
b) 50 g dung dịch CuSO4 có nồng độ 10%.
Phương pháp giải:
a) Tính cần lấy.
b) Tính khối lượng CuSO4 cần dùng Khối lượng nước cất cần dùng.
Lời giải:
a) Pha chế 50 ml dung dịch CuSO4 1M :
- Số mol CuSO4 cần dùng là :
- Cách pha chế:
Cân 8 g CuSO4 cho vào cốc chia độ. Thêm khoảng 25 - 30 ml nước cất vào cốc, dùng đũa thuỷ tinh khuấy cho CuSO4 tan hết, bỏ đũa ra ngoài, thêm từ từ nước cất cho đủ 50 ml. Trộn đều, ta được 50 ml dung dịch CuSO4 có nồng độ 1M.
b) Pha chế 50 g dung dịch CuSO4 10% :
- Khối lượng CuSO4 cần dùng là :
- Khối lượng nước cất cần dùng là :
- Cách pha chế:
Cân lấy 5 g CuSO4 cho vào cốc. Rót từ từ vào cốc 45 g hoặc 45 ml nước cất, khuấy cho CuSO4 tan hết, ta được 50 g dung dịch CuSO4 10%.
Bài 44.3 trang 60 SBT Hóa học 8: Bảng dưới đây cho biết độ tan của một muối trong nước thay đổi theo nhiệt độ :
|
Nhiệt độ (°C) |
20 |
30 |
40 |
50 |
60 |
|
Độ tan (g/100 g nước) |
5 |
11 |
18 |
28 |
40 |
a) Vẽ đồ thị biểu diễn độ tan của muối trong nước (trục tung biểu thị khối lượng chất tan, trục hoành biểu thị nhiệt độ).
b) Căn cứ vào đồ thị, hãy ước lượng độ tan của muối ở 25°C và 55°C
c) Tính số gam muối tan trong :
- 200 g nước để có dung dịch bão hoà ở nhiệt độ 20°C.
- 2 kg nước để có dung dịch bão hoà ờ nhiệt độ 50°C.
Phương pháp giải:
a) Hs vẽ đồ thị theo số liệu trong bảng.
b) Căn cứ vào đồ thị, hãy ước lượng độ tan của muối.
c) Sử dụng công thức tính độ tan S.
Lời giải:
a) Xem đồ thị
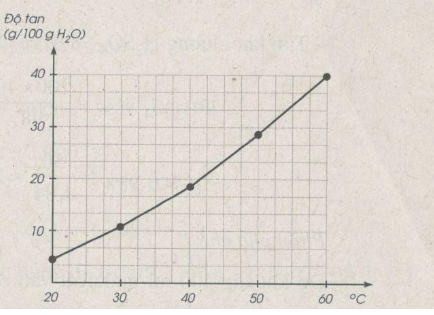
- Ở nhiệt độ 20°C : Độ tan của muối là 5 g, suy ra trong 200 g nước có khối lượng muối tan là
Bài 44.4 trang 60 SBT Hóa học 8: Người ta pha chế một dung dịch NaCl ở 20°C bằng cách hoà tan 23,5 g NaCl trong 75 g nước. Căn cứ vào độ tan của NaCl trong nước , hãy cho biết dung dịch NaCl đã pha chế là bão hoà hay chưa bão hoà. Nếu dung dịch NaCl là chưa bão hoà, làm thế nào để có được dung dịch NaCl bão hoà ở 20°C ?
Phương pháp giải:
+) Tính độ tan của muối trong 75g nước trên.
+) So sánh độ tan của NaCl trong nước Kết luận.
Lời giải:
Theo độ tan của muối NaCl trong nước ở nhiệt độ 20°C là 32 g, ở nhiệt độ này 75 g nước hoà tan tối đa được :
Như vậy, dung dịch NaCl đã pha chế là chưa bão hoà. Để có được dung dịch NaCl bão hoà ở nhiệt độ này, ta cho thêm vào dung dịch đã pha chế một khối lượng NaCl là :
Khuấy cho muối tan hết, ta được dung dịch bão hoà NaCl ở 20 °C.
Bài 44.5 trang 60 SBT Hóa học 8: Hãy tính toán và trình bày cách pha chế 0,5 lít dung dịch H2SO4 có nồng độ 1M từ H2SO4 có nồng độ 98%, khối lượng riêng là 1,84 g/ml.
Phương pháp giải:
Sử dụng công thức:
Lời giải:
Phần tính toán :
- Tìm số mol H2SO4 cần dùng để pha chế 500 ml dung dịch H2SO4 1M :
- Tìm khối lượng dung dịch H2SO4 98 % có chứa 49 g H2SO4
Phần pha chế:
Đổ khoảng 400 ml nước cất vào cốc chia độ có dung tích 1 lít. Rót từ từ 27,2 ml H2SO4 98% vào cốc, khuấy đều. Sau đó thêm dần dần nước cất vào cốc cho đủ 500 ml. Ta đã pha chế được 500 ml dung dịch H2SO4 1M.
Bài 44.6* trang 61 SBT Hóa học 8: A là dung dịch H2SO4 có nồng độ 0,2M. B là dung dịch H2SO4 có nồng độ 0,5M.
a) Nếu trộn A và B theo tỉ lệ thể tích VA : VB = 2 : 3 được dung dịch C. Hãy xác định nồng độ mol của dung dịch C.
b) Phải trộn A và B theo tỉ lệ nào về thể tích để được dung dịch H2SO4 có nồng độ 0,3M ?
Phương pháp giải:
a) +) Tim số mol H2SO4 có trong 2V dung dịch A
+) Tìm số mol H2SO4 có trong 3V dung dịch B => nồng độ mol của dung dịch C.
b) +) Đặt x (ml) và y (ml) là thể tích các dung dịch axit A và B phải lấy để có dung dịch H2SO4 0,3M.
+) Tìm số mol H2SO4 có trong x (ml) dung dịch A
+) Tìm số mol H2SO4 có trong y (ml) dung dịch B
+) Áp dụng công thức: x, y Kết luận.
Lời giải:
a) Nồng độ mol của dung dịch C:
- Tìm số mol H2SO4 có trong 2V dung dịch A :
- Tìm số mol H2SO4 có trong 3V dung dịch B :
- Nồng độ mol của dung dịch H2SO4 sau khi pha trộn :
b) Pha chế dung dịch H2SO4 0,3M
Đặt x (ml) và y (ml) là thể tích các dung dịch axit A và B phải lấy để có dung dịch H2SO4 0,3M.
- Tìm số mol H2SO4 có trong x (ml) dung dịch A là :
- Tìm số mol H2SO4 có trong y (ml) dung dịch B là :
Từ công thức tính nồng độ mol, ta có :
Giải phương trình ta có : x = 2y. Nếu y = 1, thì x = 2.
Kết luận : Ta phải trộn 2 thể tích dung dịch axit A với 1 thể tích dung dịch axit B, ta sẽ được dung dịch H2SO4 có nồng độ 0,3M.
Bài 44.7* trang 61 SBT Hóa học 8: Có 200 g dung dịch NaOH 5% (dung dịch A).
a) Cần phải trộn thêm vào dung dịch A bao nhiêu gam dung dịch NaOH 10% để được dung dịch NaOH 8% ?
b) Cần hoà tan bao nhiêu gam NaOH vào dung dịch A để có dung dịch NaOH 8% ?
c) Làm bay hơi nước dung dịch A, người ta cũng thu được dung dịch NaOH 8%. Tính khối lượng nước đã bay hơi.
Phương pháp giải:
a) +) Đặt x (g) là khối lượng dung dịch NaOH 10% cần dùng
+) Tính khối lượng NaOH có trong dung dịch ban đầu
+) Áp dụng công thức: x(g) Kết luận.
b) Đặt x (g) là khối lượng NaOH cần phải pha trộn vào dung dịch A để có dung dịch NaOH 8%.
+) x(g) Kết luận.
c) Tương tự phần a) và b)
Lời giải:
a) Khối lượng dung dịch NaOH 10% phải dùng :
- Đặt x (g) là khối lượng dung dịch NaOH 10% cần dùng. Trong đó chứa khối lượng NaOH là :
- Khối lượng NaOH có trong dung dịch ban đầu là :
Theo công thức tính nồng độ phần trăm, ta có phương trình đại số :
Giải phương trình, ta được : x = 300.
Kết luận : Phải trộn thêm 300 g dung dịch NaOH 10% ta sẽ có 200 + 300 = 500 (g) dung dịch NaOH nồng độ 8%.
b) Khối lượng NaOH cần dùng .
- Đặt x (g) là khối lượng NaOH cần phải pha trộn vào dung dịch A để có dung dịch NaOH 8%.
-Theo công thức tính nồng độ phần trăm, ta có phương trình đại số :
Giải phương trình, ta được x = 6,52 g.
Kết luận : Phải trộn thêm 6,52 g NaOH vào dung dịch A ta sẽ được dung dịch NaOH nồng độ 8%.
c) Khối lượng nước bay hơi :
- Đặt x (g) là khối lượng nước bay hơi khỏi dung dịch để có dung dịch NaOH nồng độ 8%.
- Từ công thức tính nồng độ phần trăm, ta có phương trình đại số :
Giải phương trình, ta được : x = 75.
Kết luận : Cho 75 g nước bay hơi ra khỏi 200 g dung dịch NaOH ban đầu, ta được 200 -75 = 125 (g) dung dịch NaOH có nồng độ 8%.