Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 8 Bài 32: Phản ứng oxi hóa - khử chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 8. Mời các bạn đón xem:
Giải SBT Hóa học 8 Bài 32: Phản ứng oxi hóa - khử
Bài 32.1 trang 44 SBT Hóa học 8: Phát biểu nào sau đây đúng ?
A. Chất chiếm oxi của chất khác là chất oxi hoá.
B. Chất nhường oxi cho chất khác là chất khử.
C. Sự tách oxi ra khỏi hợp chất là sự khử.
D. Sự tách oxi ra khỏi hợp chất là sự oxi hoá.
Lời giải:
Sự tách oxi ra khỏi hợp chất là sự khử.
=> Chọn C.
Bài 32.2 trang 45 SBT Hóa học 8: Thực hiện các thí nghiệm sau :
(1) Sục khí CO2 vào dung dịch Ca(OH)2.
(2) Cho khí CO qua sắt (III) oxit nung nóng.
(3) Đốt cháy Mg trong bình đựng khí CO2.
(4) Đốt cháy Fe trong bình đựng khí Cl2.
(5) Sục khí SO2 vào dung dịch NaOH.
Số thí nghiệm có xảy ra phản ứng oxi hoá - khử là
A. 3. B. 4
C. 5. D. 2.
Lời giải:
Đó là các thí nghiệm (2), (3), (4).
=> Chọn A.
Bài 32.3 trang 45 SBT Hóa học 8: Cho các sơ đồ phản ứng :
(1) H2 + Fe2O3 —----> Fe + H2O
(2) CO + Fe2O3 -------- > Fe + CO2
(3) C + H2O —------> CO + H2
(4) Al + CuO —---------> Cu + Al2O3
(5) Al + Fe2O3 -----------> Fe + Al2O3
(6) C + CO2 —--------> CO
a) Hãy lập các phương trình hoá học của các phản ứng trên.
b) Quá trình nào được gọi là sự khử ? Quá trình nào được gọi là sự oxi hoá ?
c) Trong các phản ứng trên, phản ứng nào là phản ứng oxi hoá - khử ? Vì sao ? Chất nào là chất khử, chất nào là chất oxi hoá ?
Lời giải:
a)
b)
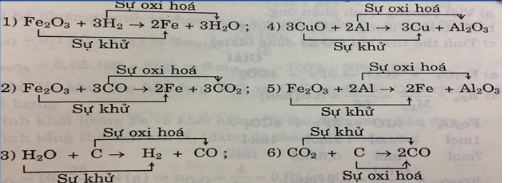
c) Những phản ứng trên là phản ứng oxi hóa - khử vì trong phản ứng xảy ra đồng thời sự oxi hóa và sự khử.
Các chất khử: H2, CO, C, Al, C
Các chất oxi hóa: Fe2O3, H2O, CuO, Fe2O3, CO2
Bài 32.4 trang 45 SBT Hóa học 8: Cho các loại phản ứng hoá học sau :
Phản ứng hoá hợp ; (2) Phản ứng phân huỷ ; (3) Phản ứng oxi hoá - khử.
Những biến đổi hoá học sau đây thuộc loại phản ứng nào ?
a) Nung nóng canxi cacbonat.
b) Sắt tác dụng với lưu huỳnh.
c) Khí CO đi qua chì (II) oxit nung nóng.
Phương pháp giải:
Phản ứng hóa hợp là phản ứng hóa học trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
Phản ứng oxi hóa – khử là phản ứng hóa học trong đó xảy ra đồng thời sự oxi hóa và sự khử.
Lời giải:
a) Nung nóng canxi cacbonat : Thuộc loại phản ứng (2).
b) Sắt tác dụng với lưu huỳnh : Thuộc loại phản ứng (1).
c) Khí CO đi qua chì (II) oxit: Thuộc loại phản ứng (3).
Bài 32.5 trang 45 SBT Hóa học 8: Phản ứng H2 khử sắt (II) oxit thuộc loại phản ứng gì ? Tính khối lượng sắt (II) oxit bị khử bởi 2,24 lít khí hiđro (đktc).
Phương pháp giải:
+) Tính số mol hiđro
+) PTHH:
+) Tính theo phương trình hóa học => khối lượng sắt (II) oxit bị khử.
Lời giải:
Phản ứng H2 khử sắt (II) là phản ứng oxi hóa -khử:
1 mol 1 mol
=
Khối lượng FeO cần dùng: 0,1 x 72 = 7,2 (g)
Bài 32.6 trang 45 SBT Hóa học 8: Cần điều chế 33,6 g sắt bằng cách dùng khí CO khử Fe3O4.
a) Viết phương trình hoá học.
b) Tính khối lượng Fe3O4 cần dùng.
c) Tính thể tích khí CO (đktc) đã dùng.
Phương pháp giải:
a)
b), c) Tính số mol Fe, dựa vào PTHH => số mol Fe3O4 và CO.
Lời giải:
a) Ta có: =
Phương trình hóa học:
1 mol 4 mol 3 mol
x mol y mol 0,6 mol
=
b) Khối lượng Fe3O4 cần dùng để điều chế 33,6 g Fe:
232 x 0,2 = 46,4 (g)
c) Thể tích khí cần dùng: 0,8 x 22,4 =17,92 (lít).
Bài 32.7 trang 46 SBT Hóa học 8: Dẫn luồng khí H2 dư đi qua 16 g hỗn hợp hai oxit CuO và Fe2O3 nung nóng. Sau phản ứng để nguội, cân lại thấy khối lượng hỗn hợp giảm 25%. Tính phần trăm khối lượng của mỗi oxit trong hỗn hợp đầu.
Phương pháp giải:
+) Gọi số mol CuO và Fe2O3 là x, y (mol)
+) PTHH:
+) Khối lượng hỗn hợp giảm
=
+) Lập hpt 2 ẩn x, y. Giải hpt
=> x, y => phần trăm khối lượng của mỗi oxit
Lời giải:
Phương trình hóa học của phản ứng:
x mol x mol
y mol 2y mol
Ta có : Khối lượng hỗn hợp giảm
=
Ta có hệ phương trình
.
Bài 32.8 trang 46 SBT Hóa học 8: Cho H2 khử 16 g hỗn hợp FeO và CuO trong đó CuO chiếm 25% khối lượng
a) Tính khối lượng Fe và khối lượng Cu thu được sau phản ứng.
b) Tính tổng thể tích khí H2 (đktc) đã tham gia phản ứng.
Phương pháp giải:
) Tính số mol FeO và CuO
+) Viết PTHH:
+) Dựa vào PTHH tính số mol Fe, Cu, H2
+) Trả lời yêu cầu bài toán.
Lời giải:
a)= =
Phương trình hóa học của phản ứng:
0,05 mol 0,05 mol 0,05 mol
0,075 mol x mol y mol
y = 0,075 x 2 = 0,15 (mol);
x = 0,075 x 3 = 0,225(mol)
b) Tổng thể tích khí cần dùng:
Bài 32.9 trang 46 SBT Hóa học 8: Người ta dùng khí cacbon oxit để khử đồng (II) oxit.
a) Nếu khử a gam đồng (II) oxit thì thu được bao nhiêu gam đồng ?
b) Cho a = 150 g, hãy tính kết quả bằng số.
Lời giải:
Phương trình hóa học :
80 g 64 g
a)
b) a =150 g Khối lượng Cu thu được : 0,8 x 150 = 120 (g).
Bài 32.10 trang 46 SBT Hóa học 8: Khử 12 g sắt(III) oxit bằng khí hiđro.
Thể tích khí hiđro (đktc) cần dùng là
A. 5,04 lít. B. 7,56 lít.
C. 10,08 lít D. 8,2 lít.
Khối lượng sắt thu được là
A. 16,8 g. B. 8,4 g.
C. 12,6 g. D. 18,6 g.
Phương pháp giải:
+) Tính số mol
+) Tính theo PTHH:
+) Trả lời yêu cầu bài toán.
Lời giải:
a) =
Phương trình hóa học:
1 mol 3 mol 2 mol
0,075 mol x mol y mol
x = 0,075 x 3 = 0,225 (mol); y = 0,075 x 2 = 0,15 (mol)
cần dùng : 0,225 x 22,4 = 5,04 (lít)
=> Chọn A.
b) Khối lượng sắt thu được là: 0,15 x 56 = 8,4 (g).
=> Chọn B.
Bài 32.11 trang 46 SBT Hóa học 8: Người ta điều chế được 24 g đồng bằng cách dùng hiđro khử đồng (II) oxit.
a) Khối lượng đồng (II) oxit bị khử là
A. 15 g. B. 45 g.
C. 60 g. D. 30 g.
b) Thể tích khí hiđro (đktc) đã dùng là
A. 8,4 lít. B. 12,6 lít.
C. 4,2 lít. D. 16,8 lít.
Phương pháp giải:
+) Tính
+) Viết PTHH:
+) Tính theo PTHH => số mol CuO và H2
+) Trả lời yêu cầu bài toán.
Lời giải:
a) =
Phương trình hóa học :
1 mol 1 mol 1 mol
x mol y mol 0,375 mol
x = 0,375 mol; y = 0,375 mol
Khối lượng CuO bị khử là: 0,375 x 80 = 30(g)
=> Chọn D.
b) cần dùng : 0,375 x 22,4 = 8,4 (lít).
=> Chọn A.