Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 8 Bài 8: Luyện tập chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 8. Mời các bạn đón xem:
Giải SBT Hóa học 8 Bài 8: Luyện tập
Bài 8.1 trang 10 SBT Hóa học 8: Cho biết sơ đồ nguyên tử một số nguyên tố như sau :
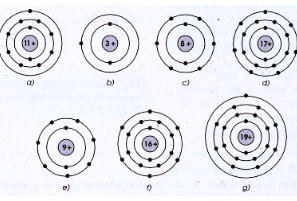
Hãy viết tên, kí hiệu hóa học và nguyên tử khối của mỗi nguyên tố.
Lời giải:
Từ sơ đồ ta có được
| STT | Tên nguyên tố | Kí hiệu hóa học | Nguyên tử khối |
|---|---|---|---|
| a) | Natri | Na | 23 |
| b) | Liti | Li | 7 |
| c) | Oxi | O | 16 |
| d) | Clo | Cl | 35,5 |
| e) | Flo | F | 19 |
| f) | Lưu huỳnh | S | 32 |
| g) | Kali | K | 39 |
Bài 8.2 trang 10 SBT Hóa học 8: Theo sơ đồ nguyên tử các nguyên tố cho trong bài tập 8.1, hãy chỉ ra :
Nguyên tử những nguyên tố nào có sự sắp xếp electron giống nhau về :
a) Số lớp electron (mấy lớp).
b) Số electron lớp ngoài cùng (mấy electron)
Lời giải:
a) Nguyên tử các nguyên tố liti, oxi và flo giống nhau về số lớp electron, cùng có hai lớp.
Nguyên tử các nguyên tố natri, lưu huỳnh và clo giống nhau, cùng có ba lớp electron.
b) Nguyên tử các nguyên tố liti, natri và kali giống nhau về số electron ở lớp ngoài cùng, đều có 1 e.
Nguyên tử các nguyên tố clo và flo giống nhau đều có 7 e ở lớp ngoài cùng.
Nguyên tử các nguyên tố lưu huỳnh và oxi giống nhau đều có 6 e ở lớp ngoài cùng.
Bài 8.3 trang 10 SBT Hóa học 8: Hãy tính xem trong 1 g hiđro có bao nhiêu nguyên từ H (Gợi ý : Cần biết khối lượng tính bằng gam của 1 nguyên tử H , xem lại bài tập 7, thuộc bài học 5 : Nguyên tố hoá học, SGK). Số nguyên tử H tính được gần với con số nào nhất trong số các con số cho sau đây ?
A. 4.1023
B. 5.1023
C. 6.1023
D. 7.1023
Phương pháp giải:
Gợi ý:
Cứ 1 đvC tương ứng với g,
Lời giải:
Cứ 1 đvC tương ứng với g,
Số nguyên tử H có trong 1 gam Hiđro là:
=> Chọn C.
Bài 8.4 trang 10 SBT Hóa học 8: Hình bên là mô hình cùng sơ đồ phân tử khí amoniac (a) và khí sunfurơ (b).
Hãy chọn các từ và con số thích hợp trong khung, điền vào chỗ trống trong đoạn
câu dưới đây.
"Hai ....... đều được tạo nên từ hai ........... Giống như phân tử nước, phân tử khí sunfurơ hình ......... , có tỉ lệ số nguyên tử bằng ......... Còn phân tử khí amoniac hình ......... có tỉ lệ số nguyên tử bằng ........."
Lời giải:
"Hai hợp chất đều được tạo nên từ hai nguyên tố. Giống như phân tử nước, phân tử khí sunfurơ hình gấp khúc, có tỉ lệ số nguyên tử bằng 1:2. Còn phân tử khí amoniac hình tháp tam giác, có tỉ lệ số nguyên tử bằng 1 : 3".
Bài 8.5 trang 10 SBT Hóa học 8: Phân tử một hợp chất gồm nguyên tử nguyên tố X liên kết với 4 nguyên tử H và nặng bằng nguyên tử O
a) Tính nguyên tử khối, cho biết tên và kí hiệu hóa học của nguyên tố X.
b) Tính phần trăm về khối lượng của nguyên tố X trong hợp chất.
Hướng dẫn : Biết rằng phần trăm về khối lượng của một nguyên tố trong hợp chất bằng phần trăm về khối lượng của nguyên tố đó trong 1 phân tử. Vì vậy, dựa vào nguyên tử khối, phân tử khối để tính. Thí dụ, phần trăm về khối lượng của nguyên tố A trong hợp chất AxBy bằng:
Lời giải:
a) Phân tử khối của hợp chất bằng nguyên tử khối của đvC.
Phân tử khối của hợp chất trên: X + 4 = 16.
Nguyên tử khối của X = 16 – 4 = 12đvC.
X là nguyên tố cacbon C.
b) Phần trăm về khối lượng của nguyên tố C trong hợp chất là:
Bài 8.6 trang 11 SBT Hóa học 8: Phân tử một hợp chất gồm nguyên tử nguyên tố Y liên kết với hai nguyên tử O. Nguyên tố oxi chiếm 50% về khối lượng của hợp chất.
a) Tính nguyên tử khối, cho biết tên và kí hiệu hoá học của nguyên tố Y.
b) Tính phân tử khối của hợp chất. Phân tử hợp chất nặng bằng nguyên tử nguyên tố nào ?
(Xem bảng 1, phần phụ lục cuối sác
Phương pháp giải:
a) Khối lượng của 2 nguyên tử oxi là 2x 16= 32 đvC. Vì mỗi nguyên tố chiếm 50% về khối lượng
=> Nguyên tử khối của Y là 32.
Xem bảng 1, phần phụ lục SGK hóa học 8 trang 42 để kết luận tên và KHHH của Y
b) Phân tử khối của hợp chất bằng khối lượng của từng nguyên tố trong hợp chất
Lời giải:
a) Khối lượng bằng đơn vị cacbon của hai nguyên tử O là : 2 X 16 = 32 (đvC)
Vì mỗi nguyên tố chiếm 50% về khối lượng nên đây cũng là khối lượng của một nguyên tử nguyên tố Y. Nguyên tử khối của Y bằng 32 đvC, Y là nguyên tố lưu huỳnh S
b) Phân tử khối của hợp chất bằng :
32 + 2 x 16 = 64 (đvC)
Phân tử nặng bằng nguyên tử đồng (Cu = 64 đvC).
Bài 8.7 trang 11 SBT Hóa học 8: Dùng phễu chiết (hình trang 11 SBT hóa học 8), hãy nói cách làm để tách nước ra khỏi dầu ôliu (dầu ăn).

Cho biết dầu ôliu là một chất lỏng, có khối lượng riêng (D) khoảng 0,91 g/ml và không tan trong nước.
Phương pháp giải:
Phễu chiết dùng để tách 2 chất lỏng có khối lượng riêng khác nhau và không tan vào nhau.
Chất có khối lượng riêng nhỏ hơn (nhẹ hơn) sẽ ở phía trên, chất khối lượng riêng lớn hơn (nặng hơn) ở phía dưới. Khi mở khóa phễu chất nặng hơn sẽ chảy ra trước.
Lời giải:
Đổ hỗn hợp nước và dầu ôliu vào phễu chiết. Dầu ôliu không tan trong nước và nhẹ hơn nước nên nổi thành một lớp ở trên. Nước tách thành một lớp ở dưới. Mở phễu cho nước chảy ra từ từ đến khi hết nước thì đóng khoá phễu lại
Bài 8.8 trang 11 SBT Hóa học 8: Bảng bên là khối lượng riêng của một số chất, ghi trong điều kiện thông thường.
| Chất | Khối lượng riêng (g/cm3) |
| Đồng | 8,92 |
| Kẽm | 7,14 |
| Nhôm | 2,70 |
| Khí oxi | 0,00133 |
| Khí nitơ | 0,00117 |
Em có nhận xét gì về khối lượng riêng của các chất rắn so với các chất khí ? Hãy giải thích.
Lời giải:
Khối lượng riêng của các chất rắn lớn hơn rất nhiều (hàng nghìn lần) so với các chất khí là vì ở trạng thái khí các phân tử ở rất xa nhau, có khoảng trống rất lớn giữa các phân tử.
Bài 8.9 trang 11 SBT Hóa học 8: a) Xem lại bài tập 8.3* để biết 1 đvC tương ứng với bao nhiêu gam. Từ đó tính khối lượng bằng gam của :
6,02.1023 nguyên tử oxi ;
6,02.1023 nguyên tử flo ;
6,02.1023 nguyên tử nhôm. (Biết rằng, trong phép tính với số mũ ta có :
b) Nêu nhận xét về các số trị của các giá trị khối lượng tính được này và số trị nguyên tử khối của mỗi nguyên tố.
Lời giải:
a) Khối lượng tính bằng gam của nguyên tử oxi (1 nguyên tử khối nặng 16 đvC ) bằng :
Tương tự:
* 6,02.1023 nguyên tử flo (1 nguyên tử khối nặng 19 đvC ):
6,02.1023.19. 1,66.10-24 = 18, 987(g) ≈ 19 (g)
* 6,02.1023 nguyên tử nhôm (1 nguyên tử khối nặng 27 đvC ):
6,02.1023.19. 1,66.10-24 = 26,98(g) ≈ 27(g)
b) Số trị của các giá trị khối lượng được tính bằng chính số trị nguyên tử khối của mỗi nguyên tố. Tương tự, 1g là khối lượng tính bằng gam của nguyên tử H, nguyên tử khối của nguyên tố là 1 đvC, có cùng số trị 1)