Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 9 Bài 37: Etilen chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Etilen lớp 9.
Giải bài tập Hóa học lớp 9 Bài 37: Etilen
Câu hỏi và bài tập (trang 119 SGK Hóa học 9)
Bài 1 trang 119 SGK Hóa học 9 : Hãy tính số liên kết đơn, liên kết đôi giữa những nguyên tử cacbon trong phân tử các chất sau:
a) CH3 - CH3;
b) CH2 = CH2;
c) CH2 = CH - CH = CH2.
Lời giải :
a) CH3 - CH3 có 1 liên kết đơn C-C
b) CH2 = CH2 có 1 liên kết đôi C=C
c) CH2 = CH - CH = CH2 có 2 liên kết đôi C=C và 1 liên kiết đơn C-C
Bài 2 trang 119 SGK Hóa học 9 : Điền từ thích hợp “có” hoặc “không” vào các cột sau:
|
Có liên kết đôi |
Làm mất màu dung dịch brom |
Phản ứng trùng hợp |
Tác dụng với oxi |
|
|
Metan |
||||
|
Etilen |
Lời giải :
|
Có liên kết đôi |
Làm mất màu dung dịch brom |
Phản ứng trùng hợp |
Tác dụng với oxi |
|
|
Metan |
không |
không |
không |
có |
|
Etilen |
có 1 liên kết đôi |
có |
có |
có |
Bài 3 trang 119 SGK Hóa học 9 : Hãy nêu phương pháp hoá học loại bỏ khí etilen có lẫn trong khí metan để thu đuợc metan tinh khiết.
Lời giải :
Dẫn hỗn hợp khí qua bình đựng dung dịch brom dư, khí etilen phản ứng hết tạo thành đibrometan là chất lỏng ở trong dung dịch. Khí thoát ra là CH4 , xảy ra phản ứng:
CH2 = CH2 + Br2 → Br-CH2-CH2-Br
Bài 4 trang 119 SGK Hóa học 9
Để đốt cháy 4,48 lít khí etilen cần phải dùng :
a) Bao nhiêu lít oxi ?
b) Bao nhiêu lít không khí chứa 20% thể tích oxi ?
Biết thể tích các khí đo ở điều kiện tiêu chuẩn.
Phương pháp giải :
- Tính số mol khí etilen.
- Viết PTHH khi đốt cháy etilen.
- Đặt số mol vào phương trình hóa học suy ra số mol của oxi.
- Dựa vào thành phần phần trăm về thể tích của oxi trong không khí ta tính được thể tích của không khí cần dùng.
Lời giải:
Số mol C2H4 = 4,48 : 22,4 = 0,2 mol
Phương trình phản ứng đốt cháy etilen:
C2H4 + 3O2 2CO2 + 2H2O
Pư: 0,2 0,6 0,4 (mol)
a) =0,6 x 22,4 = 13,44 lít
b) => Vkk = 5 = 5 x 13,44 = 67,2 lít
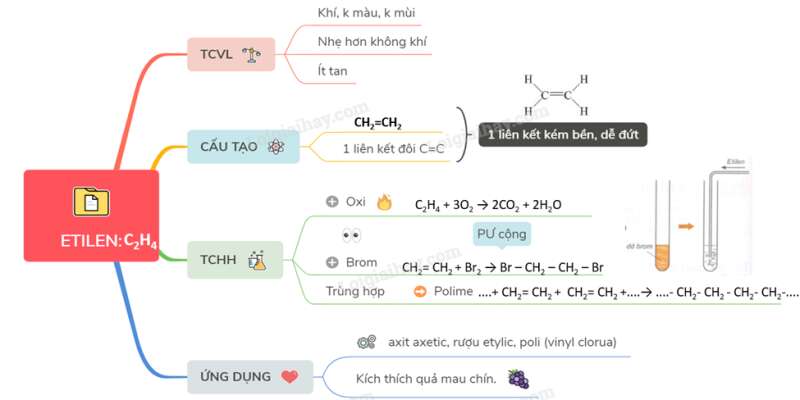
I. TÍNH CHẤT VẬT LÍ
- Là chất khí, không màu, không mùi.
- Tan rất ít trong nước.
II. CẤU TẠO PHÂN TỬ
- Etilen có công thức cấu tạo:
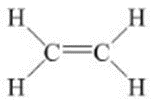
Viết gọn là : CH2=CH2
- Trong phân tử etilen C2H4, có một liên kết đôi giữa hai nguyên tử cacbon.
Chú ý: Trong liên kết đôi có một liên kết kém bền. Liên kêt này dễ đứt ra trong các phản ứng hóa học.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với oxi:
Khi đốt trong oxi, etilen cháy tạo thành khí CO2 và H2O, tỏa nhiều nhiệt.
PTHH:
C2H4 + 3O2 2CO2 + 2H2O
Nhận xét: Khi đốt cháy khí etilen thu được số mol CO2 bằng số mol H2O.
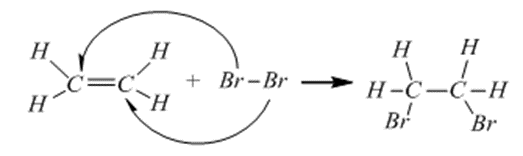
2. Tác dụng với dung dịch brom (phản ứng cộng).
PTHH:
CH2= CH2 + Br2 → Br – CH2 – CH2 – Br
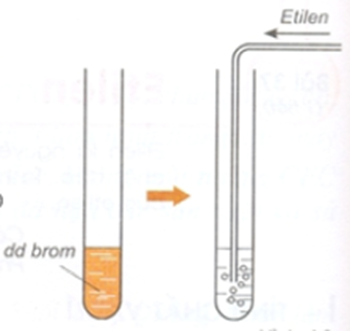
+ Dung dịch Br2 ban đầu có màu vàng nâu. Sục khí etilen vào dung dịch => dung dịch mất màu
Nhận xét:
– Liên kết kém bền trong liên kết đôi bị đứt ra và mỗi phân tử etilen đã kết hợp thêm một phân tử brom.
– Phản ứng trên gọi là phản ứng cộng. Ngoài brom, trong những điều kiện thích hợp etilen có thể tham gia phản ứng cộng với Cl2, H2, HBr…
– Các chất có liên kết đôi như etilen dễ tham gia phản ứng cộng.
3. Các phân tử etilen kết hợp với nhau (phản ứng trùng hợp)
- Ở điều kiện thích hợp các phân tử etilen kết hợp với nhau tạo ra chất có phân tử lượng rất lớn gọi là polime.
PTHH:
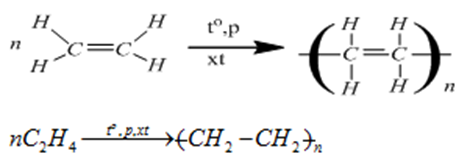
Chú ý:
- Phản ứng trên là phản ứng trùng hợp.
- Poli etilen là chất không tan trong nước, không độc, là nguồn nguyên liệu quan trọng trong công nghiệp chất dẻo.
IV. ỨNG DỤNG
- Etilen dùng để điều chế axit axetic, rượu etylic, poli (vinyl clorua),...
- Etilen dùng kích thích quả mau chín.
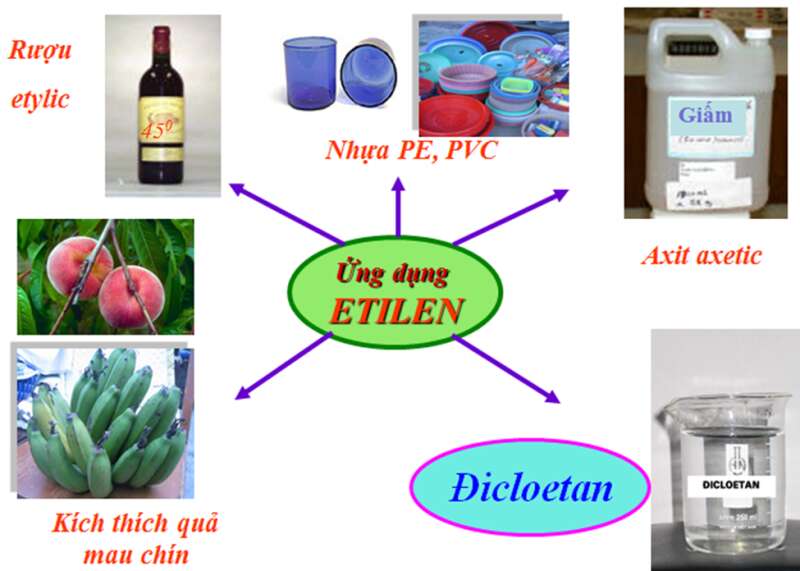
V. ĐIỀU CHẾ
C2H5OH CH2=CH2 + H2O
Sơ đồ tư duy: Etilen