Tailieumoi.vn xin giới thiệu phương trình 6NaOH + 3Cl2 -90oC→ 5NaCl + NaClO3 + 3H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Natri. Mời các bạn đón xem:
Phương trình 6NaOH + 3Cl2 -90oC→ 5NaCl + NaClO3 + 3H2O
1. Phương trình phản ứng hóa học:
6NaOH + 3Cl2 -90oC→ 5NaCl + NaClO3 + 3H2O
Cách lập phương trình hoá học:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hoá, từ đó xác định chất oxi hoá – chất khử:
Chất khử và chất oxi hoá đều là: Cl2.
Bước 2: Biểu diễn quá trình oxi hoá, quá trình khử
- Quá trình oxi hoá:
- Quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá
Bước 4: Điền hệ số của các chất có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Cl2 + 2NaOH → NaCl + NaClO + H2O
2. Hiện tượng nhận biết phản ứng
- Ban đầu mẩu quỳ có màu xanh, sau khi phản ứng xảy ra màu xanh của quỳ bị mất.
3. Điều kiện phản ứng
Phản ứng xảy ra ở khoảng 900C.
4. Tính chất hóa học
4.1. Tính chất hóa học của NaOH
NaOH Là một bazơ mạnh nó sẽ làm quỳ tím chuyển màu xanh, còn dung dịch phenolphtalein thành màu hồng. Một số phản ứng đặc trưng của Natri Hidroxit được liệt kê ngay dưới đây.
Phản ứng với axit tạo thành muối + nước:
NaOHdd + HCldd→ NaCldd + H2O
Phản ứng với oxit axit: SO2, CO2…
2 NaOH + SO2→ Na2SO3 + H2O
NaOH + SO2→ NaHSO3
Phản ứng với muối tạo bazo mới + muối mới (điều kiện: sau phản ứng phải tạo thành chất kết tủa hoặc bay hơi):
2 NaOH + CuCl2→ 2NaCl + Cu(OH)2↓
Tác dụng với kim loại lưỡng tính:
2 NaOH + 2Al + 2H2O→ 2NaAlO2 + 3H2↑
2NaOH + Zn → Na2ZnO2 + H2↑
Tác dụng với hợp chất lưỡng tính:
NaOH + Al(OH)3 → NaAl(OH)4
2NaOH + Al2O3 → 2NaAlO2 + H2O
4.2. Tính chất hóa học của ClO
- Nguyên tử clo có độ âm điện lớn (3,16) chỉ sau F (3,98) và O (3,44). Vì vậy trong các hợp chất với các nguyên tố này clo có số oxi hóa dương (+1; +3; +5; +7), còn trong các trường hợp khác clo có số oxi hóa âm (-1).
- Khi tham gia phản ứng hóa học clo dễ dàng nhận thêm 1 electron:
Cl + 1e → Cl-
⇒ Tính chất hóa học cơ bản của clo là tính oxi hóa mạnh.
Tác dụng với kim loại
- Khí clo oxi hóa trực tiếp được hầu hết các kim loại tạo thành muối clorua. Phản ứng xảy ra ở nhiệt độ thường hoặc không cao lắm, phản ứng xảy ra nhanh, tỏa nhiều nhiệt.
- Ví dụ:
2Na + Cl2 2NaCl
2Fe + 3Cl2 2FeCl3
Cu + Cl2 CuCl2
- Trong phản ứng với kim loại clo thể hiện tính oxi hóa.
Tác dụng với hiđro
- Ở nhiệt độ thường và trong bóng tối, khí clo hầu như không phản ứng với khí hiđro.
- Khi chiếu sáng hỗn hợp bởi ánh sáng mặt trời hoặc ánh sáng của magie cháy, phản ứng xảy ra và có thể nổ. Hỗn hợp nổ mạnh nhất khi tỉ lệ số mol giữa hiđro và clo là 1 :
- Phương trình hóa học:
H2 + Cl2 2HCl
- Trong phản ứng với H2, clo thể hiện tính oxi hóa.
Tác dụng với nước
- Khi tan trong nước, một phần khí clo tác dụng với nước tạo ra hỗn hợp axit clohiđric và axit hipoclozơ.
- Phương trình hóa học:
Trong phản ứng trên clo vừa là chất oxi hóa vừa là chất khử.
- Phản ứng trên là phản ứng thuận nghịch do HClO là chất oxi hóa mạnh, có thể oxi hóa HCl thành Cl2 và H2O. Cũng do HClO có tính oxi hóa mạnh nên nước clo có tính tẩy màu.
- Chú ý: Thành phần của nước clo gồm: Cl2; HCl; HClO; H2O
Mở rộng:
Ngoài ra, clo có thể tham gia một số phản ứng hóa học khác như:
- Tác dụng với dung dịch bazơ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6KOH KClO3 + 5KCl + 3H2O
- Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
- Tác dụng với chất khử khác
3Cl2 + 2NH3 → N2 + 6HCl
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
5. Cách thực hiện phản ứng
- Dẫn khí Cl2 vào ống nghiệm chứa dung dịch NaOH đun nóng và mẩu quỳ tím.
6. Bạn có biết
- Tương tự NaOH, Clo có thể phản ứng với các dung dịch kiềm ở nhiệt độ cao cho muối clorat.
7. Bài tập liên quan
Ví dụ 1: NaOH không thể phản ứng với khí nào sau ở điều kiện thường?
A. SO2.
B. CO2.
C. Cl2.
D. H2.
Hướng dẫn giải
NaOH không thể phản ứng với H2.
Đáp án D.
Ví dụ 2: Cho Clo phản ứng vừa đủ với NaOH ở 900C, dung dịch thu được có chứa các chất nào sau đây?
A, NaCl và NaClO.
B. NaClO.
C. NaCl và NaClO3.
D. NaCl.
Hướng dẫn giải
6NaOH + 3Cl2 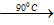
Đáp án C.
Ví dụ 3: Thể tichs khí clo ở đktc cần dung để phản ứng vừa đủ với 100ml NaOH 1M ở 900C là
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Hướng dẫn giải
Đáp án A.
Ví dụ 4:Cho 13,44 lít khí clo (đktc) đi qua 2,5 lít dung dịch KOH ở 1000C. Sau khi phản ứng xảy ra hoàn toàn, thu được 37,25 gam KCl. Dung dịch KOH trên có nồng độ là
A. 0,24M
B. 0,20M
C. 0,40M
D. 0,48M
Hướng dẫn giải:
Đáp án A
Vì Cl2 dư, KOH phản ứng hết
→ Tính số mol KOH theo KCl
→ nKOH = 0,6 mol
→ CM(KOH) = 0,24M
Ví dụ 5:Cho V lít Cl2 tác dụng với dung dịch NaOH vừa đủ ở điều kiện thường, cô cạn dung dịch thu được m1 gam muối khan. Cũng lấy V lít Cl2 cho tác dụng với dung dịch NaOH vừa đủ, đun nóng ở 80oC, cô cạn dung dịch thu được m2 gam muối. Thể tích khí Cl2 đo ở cùng điều kiện. Tỉ lệ m1:m2 là
A. 1:2
B. 1:1,5.
C. 1:1
D. 2:1.
Hướng dẫn giải:
Đáp án C
Bảo toàn khối lượng cho phương trình (1)
(*)
Bảo toàn khối lượng cho phương trình (2)
(**)
Theo phương trình:
Từ (*) và (**) → m1 = m2
→ m1 : m2 = 1:1
Ví dụ 6: Thể tích khí Cl2 (đktc) thu được khi cho 3,95 gam KMnO4 phản ứng hết với dung dịch HCl (lấy dư) là
A. 1,4000 lít
B. 1,4560 lít
C. 1,3440 lít
D. 0,0625 lít
Hướng dẫn giải:
Đáp án A
Bảo toàn electron:
lít
Ví dụ 7:Cho 1 lít H2 (đktc) tác dụng với 0,672 lít Cl2 (đktc) rồi hòa tan sản phẩm vào nước để được 20 gam dung dịch A. Lấy 5 gam A tác dụng với dung dịch AgNO3 dư thu được 1,435 gam kết tủa. Tính hiệu suất phản ứng giữa H2 và Cl2 (giả sử Cl2 và H2 không tan trong nước)
A. 50%
B. 33,33%
C. 60%
D. 66,67%
Hướng dẫn giải:
Đáp án D
H2 + Cl2 → 2HCl
Vì hiệu suất phản ứng tính theo Cl2
AgNO3 + HCl → AgCl ↓ + HNO3
→ nHCl (5g A) = nAgCl = 0,01 mol
→ nHCl (20g A) = 0,01.4 = 0,04 mol
Theo phương trình:
Ví dụ 8: Trong phản ứng: Cl2 + H2O HCl + HClO clo đóng vai trò
A. Là chất khử
B. Vừa là chất oxi hóa, vừa là chất khử
C. Là chất oxi hóa
D. Không là chất oxi hóa, không là chất khử
Hướng dẫn giải:
Đáp án B
Xét sự thay đổi số oxi hóa của Cl:
+ Tăng từ 0 lên +1 (trong HClO)
+ Giảm từ 0 xuống -1 (trong HCl)
⇒ Clo vừa là chất khử vừa là chất oxi hóa
Ví dụ 9:Nước clo có màu:
A. vàng lục
B. vàng da cam
C. vàng đậm
D. vàng nhạt
Hướng dẫn giải:
Đáp án A
Dung dịch nước clo là dung dịch hỗn hợp giữa Cl2, HCl và HClO nên có màu vàng lục, mùi hắc của clo.
Ví dụ 10: Hiện tượng xảy ra khi cho dây sắt nóng đỏ vào bình đựng khí clo là:
A. Có khói trắng
B. Có khói nâu
C. Có khói đen
D. Có khói tím
Hướng dẫn giải:
Đáp án B
2Fe + 3Cl2 → 2FeCl3 (có màu nâu)
Ví dụ 11: Cho sơ đồ chuyển hóa sau: Cl2 → X → Y → Z → X → Cl2. Trong đó X, Y, Z là các chất rắn; Y và Z đều chứa natri. X, Y, Z là
A. NaCl, NaBr, Na2CO3
B. NaBr, NaOH, Na2CO3
C. NaCl, Na2CO3, NaOH
D. NaCl, NaOH, Na2CO3
Hướng dẫn giải:
Đáp án D
Cl2 → NaCl → NaOH → Na2CO3 → NaCl → Cl2.
2Na + Cl2 → 2NaCl
2NaCl +2H2O 2NaOH + H2 + Cl2
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + 2HCl → 2NaCl + H2O + CO2
2NaCl +2H2O2NaOH + H2 + Cl2
Ví dụ 12: Đốt cháy hết 13,6g hỗn hợp Mg, Fe trong bình kín chứa khí clo dư, sau phản ứng thì lượng clo trong bình giảm tương ứng 0,4 mol. Khối lượng muối clorua khan thu được là.
A. 65,0 g. B. 38,0 g. C. 50,8 g. D. 42,0 g.
Hướng dẫn giải
Đáp án D
mmuối = mKL
Ví dụ 13: Nước Gia-ven là hỗn hợp các chất nào sau đây?
A. HCl, HClO, H2O. B.NaCl, NaClO, H2O.
C. NaCl, NaClO3, H2O. D. NaCl, NaClO4, H2O.
Hướng dẫn giải
Đáp án B
Cho khí clo tác dụng với dung dịch NaOH loãng ở nhiệt độ thường ta thu được nước Gia-Ven theo PTHH sau: 2NaOH + Cl2 → NaCl + NaClO + H2O.
8. Một số phương trình phản ứng hóa học khác của Natri và hợp chất:
NaOH + CH3COOH → CH3COONa + H2O
NaOH + NH4Cl -to→ NaCl+ NH3↑ + H2O
NaOH + NH4NO3 -to→ NaNO3+ NH3↑ + H2O