Với tóm tắt lý thuyết Hóa học lớp 12 Bài 20: Kim loại trong tự nhiên và phương pháp tách kim loại sách Kết nối tri thức hay, chi tiết cùng với 10 bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 12.
Lý thuyết Hóa học 12 Bài 20: Kim loại trong tự nhiên và phương pháp tách kim loại
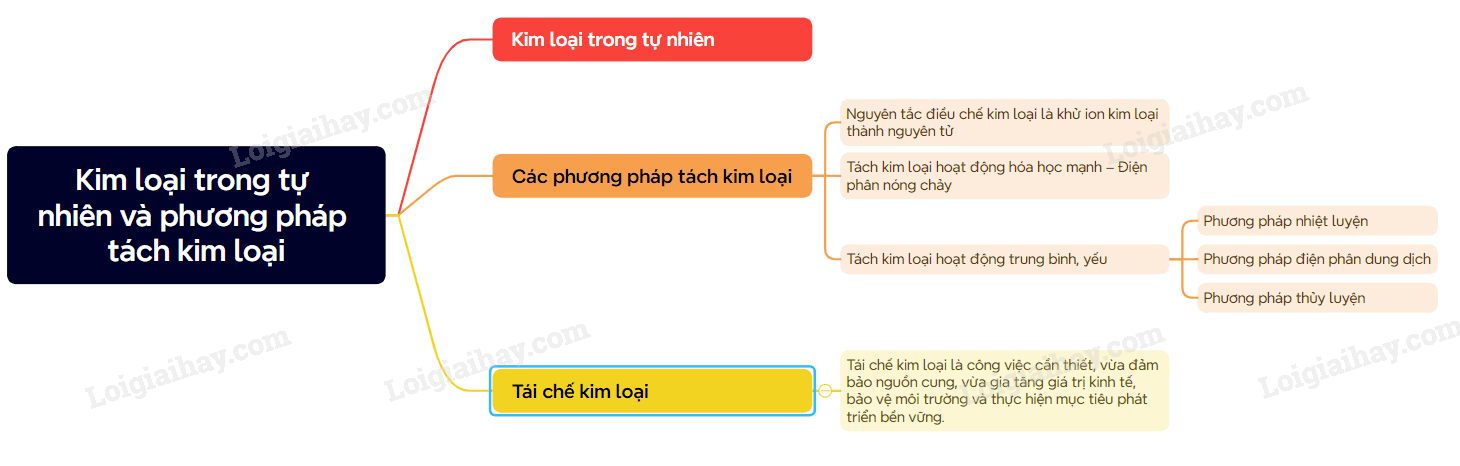
A. Lý thuyết Kim loại trong tự nhiên và phương pháp tách kim loại
I. Kim loại trong tự nhiên
Trong tự nhiên, hầu hết các kim loại tồn tại ở dạng hợp chất (oxide, muối,…) trong quặng, chỉ một số kim loại kém hoạt động như vàng, bạc, platinum,… được tìm thấy dưới dạng đơn chất.
II. Các phương pháp tách kim loại
1. Nguyên tắc
Nguyên tắc điều chế kim loại là khử ion kim loại thành nguyên tử: Mn+ + ne M
2. Tách kim loại hoạt động hóa học mạnh – Điện phân nóng chảy
a) Điện phân oxide nóng chảy
b) Điện phân muối chloride nóng chảy
3. Tách kim loại hoạt động trung bình, yếu
a) Phương pháp nhiệt luyện
- Nguyên tử: Khử các oxide kim loại ở nhiệt độ cao bằng chất khử như C, CO,…
- Những kim loại có độ hoạt động trung bình, yếu như Zn, Fe, Sn, Pb, Cu,… thường được điều chế bằng phương pháp nhiệt luyện.
b) Phương pháp điện phân dung dịch
Kim loại hoạt động trung bình hoặc yếu có thể được điều chế bằng cách điện phân dung dịch muối của chúng.
c) Phương pháp thủy luyện
Cơ sở của phương pháp này là dùng những dung dịch thích hợp như dung dịch H2SO4, NaOH, NaCN,… để hòa tan kim loiạ hoặc hợp chất của kim loại, tách phần không tan ra khỏi dung dịch.
III. Tái chế kim loại
Tái chế kim loại là công việc cần thiết, vừa đảm bảo nguồn cung, vừa gia tăng giá trị kinh tế, bảo vệ môi trường và thực hiện mục tiêu phát triển bền vững.
+ Tái chế nhôm
+ Tái chế đồng
+ Tái chế sắt
Sơ đồ tư duy Kim loại trong tự nhiên và phương pháp tách kim loại
B. Trắc nghiệm Kim loại trong tự nhiên và phương pháp tách kim loại
Câu 1. Trong quá trình tái chế kim loại, ở công đoạn phân loại phế liệu, có thể dùng nam châm lớn để tách riêng phế liệu
A. nhôm.
B. thép.
C. đồng.
D. kẽm
Đáp án đúng là: B
Vì thép có thành phần là sắt nên có tính từ, bị nam châm hút.
Câu 2. Nguyên tác tách kim loại ra khỏi hợp chất của chúng là
A. khử ion kim loại trong hợp chất thành nguyên tử.
B. oxy hóa ion kim loại trong hợp chất thành nguyên tử.
C. hòa tan các khoáng vật có trong quặng để thu được kim loại.
D. dựa trên tính chất của kim loại như từ tính, khối lượng riêng lớn để tách chúng ra khỏi quặng.
Đáp án đúng là: A
Nguyên tắc tách kim loại ra khỏi hợp chất của chúng là khử ion kim loại trong hợp chất thành nguyên tử.
Câu 3. Trong công nghiệp, Mg có thể được điều chế bằng cách nào dưới đây?
A. Điện phân nóng chảy MgCl2.
B. Cho kim loại Zn vào dung dịch MgCl2.
C. Điện phân dung dịch MgSO4.
D. Cho kim loại Na vào dung dịch Mg(NO3)2.
Đáp án đúng là: A
Trong công nghiệp, Mg có thể được điều chế bằng cách điện phân nóng chảy MgCl2.
Câu 4. Cho luồng khí CO dư qua hỗn hợp các oxide CuO, Fe2O3, Al2O3, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn thu được gồm
A. Cu, Fe, Al, Mg.
B. Cu, FeO, Al2O3, MgO.
C. Cu, Fe, Al2O3, MgO.
D. Cu, Fe, Al, MgO.
Đáp án đúng là: C
Sau phản ứng, hỗn hợp chất rắn thu được gồm Cu, Fe, Al2O3, MgO do Al2O3, MgO không bị khử bởi CO.
Câu 5. Phương pháp thích hợp để điều chế những kim loại có tính khử mạnh (từ Li đến Al) là
A. điện phân nóng chảy.
B. điện phân dung dịch.
C. nhiệt luyện.
D. thủy luyện.
Đáp án đúng là: A
Phương pháp thích hợp để điều chế những kim loại có tính khử mạnh (từ Li đến Al) là điện phân nóng chảy.
Câu 6. Kim loại nào sau đây thường có ở dạng đơn chất trong tự nhiên?A. Đồng.
B. Kẽm.
C. Vàng.
D. Sắt.
Đáp án đúng là: C
Kim loại thường có ở dạng đơn chất trong tự nhiên là vàng do tính khử của vàng yếu, khó tác dụng với các chất khác để tạo thành hợp chất.
Câu 7. Chất nào dưới đây là thành phần chính của quặng hematite?
A. Iron(II) oxide.
B. Iron(III) oxide.
C. Iron.
D. Iron(II) sulfide.
Đáp án đúng là: B
Iron(III) oxide (Fe2O3) là thành phần chính của quặng hematite.
Câu 8. Phản ứng giữa ZnO và C để tách kim loại
A. là phản ứng toả nhiệt.
B. là phản ứng không có sự thay đổi số oxi hoá.
C. là phản ứng dựa vào phương pháp thuỷ luyện.
D. có sự tạo thành kẽm ở thể hơi.
Đáp án đúng là: D
Kẽm sinh ra trong quá trình nhiệt luyện ở thể hơi vì phản ứng nhiệt luyện có nhiệt độ cao, lớn hơn nhiệt độ sôi của kẽm.
Câu 9. Trong công nghiệp, nhôm được tách ra từ quặng bauxite bằng cách nào sau đây?
A. Nung nóng quặng bauxite.
B. Nung nóng quặng bauxite với carbon.
C. Nung nóng quặng bauxite với hydrogen.
D. Điện phân nóng chảy quặng bauxite.
Đáp án đúng là: D
Phương trình phản ứng hóa học:
Câu 10. Để điều chế Ca từ CaCO3 cần thực hiện ít nhất mấy phản ứng?
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án đúng là: A
Phản ứng (1): CaCO3 + 2HCl →CaCl2 + CO2 + H2O
Phản ứng (2): CaCl2 Ca + Cl2
Câu 11. Ở Việt Nam có mỏ quặng hematite ở Trại Cau, tỉnh Thái Nguyên. Vì vậy, nước ta đã xây dựng khu công nghiệp gang – thép ở Thái Nguyên.
a. Thành phần chính của quặng hematite là Fe3O4.
b. Quặng hematite có thể tan trong dung dịch HCl.
c. Quặng hematite là nguyên liệu chính để luyện thép.
d. Từ một tấn quặng hematite (chứa 60% iron oxide), điều chế được 0,35 tấn gang (chứa 95% Fe) biết hiệu suất quá trình sản xuất là 75%.
a. Sai vì thành phần chính của quặng hematite là Fe2O3
b. Đúng.
c. Sai vì quặng hematite là nguyên liệu chính để luyện gang.
d. Sai vì Fe2O3 2Fe ⟹ tấn.
Câu 12. Xét phương trình hóa học sau: X(s) + CuSO4(aq) → XSO4(aq) + Cu(s)
a. Đây là phương pháp thủy luyện để điều chế kim loại Cu.
b. X là kim loại hoạt động hóa học mạnh hơn Cu.
c. X có thể là kim loại Ca.
d. Phương pháp điều chế trên có thể áp dụng điều chế kim loại Al, Mg trong công nghiệp.
a. Đúng.
b. Đúng.
c. Sai vì Ca sẽ phản ứng với H2O trước sinh ra Ca(OH)2 sau đó Ca(OH)2 mới phản ứng với CuSO4 tạo ra Cu(OH)2 nên sẽ không sinh như phản ứng trên.
d. Sai vì phương pháp thủy luyện thường dùng để tách những kim loại hoạt động hóa học yếu như Cu, Ag, Cu,...
Câu 13. Khử 1,5 tấn quặng hematite (thành phần chính là Fe2O3) chứa 30% tạp chất trơ bằng khí hydrogen ở nhiệt độ cao. Biết rằng hiệu suất phản ứng H = 83%. Tính số tấn Fe thu được từ quá trình tinh chế trên (Làm tròn kết quả đến hàng phần trăm).
Đáp số: 0,61.
Giải thích:
Ta có: = 1,05 tấn
Fe2O3 + 3H2 → 2Fe + 3H2O
Ta có: Cứ 160 tấn Fe2O3 → (2.56 = 112) tấn Fe
1,05 tấn Fe2O3 → 0,735 tấn Fe
Vì H = 75% nên khối lượng Fe thu được là m = 0,735.83% = 0,61 (tấn).
Câu 14. Ngâm một miếng kẽm sạch trong 250mL dung dịch AgNO3. Sau khi phản ứng kết thúc, lấy miếng kẽm ra khỏi dung dịch rửa sạch nhẹ bằng nước cất và sấy khô rồi đem cân thấy khối lượng miếng kẽm tăng 0,95 gam so với ban đầu. Tính nồng độ mol của dung dịch AgNO3 đã dùng.
Đáp số: 0,05.
Giải thích:
Gọi nồng độ mol của dung dịch AgNO3 là x (M) → = 0,25x (mol)
Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
0,125x ← 0,25x → 0,25x (mol)
Ta có : mZn tăng = mAg bám vào – mZn (phản ứng)
→ 0,95 = 0,25x.108 – 0,125x.65 → x = 0,05 (M)
Câu 15. Tiến hành các thí nghiệm sau:
(a) Cho Zn vào dung dịch AgNO3.
(b) Cho Fe vào dung dịch Fe2(SO4)3.
(c) Cho Na vào dung dịch CuSO4.
(d) Dẫn khí CO (dư) qua bột CuO nóng.
Có bao nhiêu thí nghiệm tạo thành kim loại?
Đáp số: 2.
Giải thích:
Thí nghiệm tạo thành kim loại là (a) và (b).
Phương trình hóa học của các phản ứng:
(a) Cho Zn vào dung dịch AgNO3: Zn + 2AgNO3 → Zn(NO3)2 + 2Ag.
(b) Cho Fe vào dung dịch Fe2(SO4)3: Fe + Fe2(SO4)3 → 3FeSO4.
(c) Cho Na vào dung dịch CuSO4:
2Na + 2H2O → 2NaOH + H2;
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2.
(d) Dẫn khí CO (dư) qua bột CuO nóng: CO + CuO Cu + CO2.
Xem thêm các bài tóm tắt lý thuyết Hóa học lớp 12 Kết nối tri thức hay, chi tiết khác: