Tailieumoi.vn xin giới thiệu phương trình 2KOH + H2S → K2S + 2H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Kali. Mời các bạn đón xem:
Phương trình 2KOH + H2S → K2S + 2H2O
1. Phương trình phản ứng hóa học:
2KOH + H2S → K2S + 2H2O
2. Hiện tượng nhận biết phản ứng
- Quan sát sự chuyển màu của chỉ thị phù hợp trước và sau phản ứng.
3. Điều kiện phản ứng
- Phản ứng xảy ra ngay điều kiện thường.
4. Tính chất hóa học
- KOH là một bazo mạnh có khả năng làm thay đổi màu sắc các chất chỉ thị như khiến quỳ tím chuyển sang màu xanh, còn dung dịch phenolphtalein không màu thành màu hồng.
Ở điều kiện nhiệt độ phòng, KOH tác dụng với oxit axit như SO2, CO2
KOH + SO2 → K2SO3 + H2O
KOH + SO2 → KHSO3
- KOH tác dụng với axit tạo thành muối và nước
KOH(dd) + HCl(dd) → KCl(dd) + H2O
- KOH tác dụng với các axit hữu cơ để tạo thành muối và thủy phân este, peptit
RCOOR1 + KOH → RCOOK + R1OH
- KOH tác dụng với kim loại mạnh tạo thành bazo mới và kim loại mới
KOH + Na → NaOH + K
- KOH tác dụng với muối để tạo thành muối mới và axit mới
2KOH + CuCl2 → 2KCl + Cu(OH)2↓
- KOH là một bazo mạnh, trong nước phân ly hoàn toàn thành ion Na+ và OH-
Phản ứng với một số oxit kim loại mà oxit, hidroxit của chúng lưỡng tính như nhôm, kẽm,…
2KOH + 2Al + 2H2O → 2KAlO2 + 3H2↑
2KOH + Zn → K2ZnO2 + H2↑
- KOH phản ứng với một số hợp chất lưỡng tính
KOH + Al(OH)3 → KAlO2 + 2H2O
2KOH + Al2O3 → 2KAlO2 + H2O
5. Cách thực hiện phản ứng
- Dẫn khí H2S vào ống nghiệm chứa KOH và vài giọt chất chỉ thị.
6. Bạn có biết
- KOH phản ứng với H2S tùy theo tỉ lệ về số mol mà sản phẩm thu được có thể là muối sunfua trung hòa hoặc muối axit hoặc hỗn hợp cả hai muối.
- KOH phản ứng với H2S chỉ thu được muối K2S khi T = 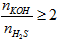
7. Bài tập liên quan
Ví dụ 1: Cho 2,24 lít khí H2S ở đktc phản ứng với lượng dư dung dịch KOH thu được dung dịch X. Khối lượng muối tan có trong X là
A. 11 gam.
B. 12 gam.
C. 13 gam.
D. 14 gam.
Hướng dẫn giải
Do KOH dư nên có phản ứng
mmuối = 0,1.110 = 11 gam.
Đáp án A.
Ví dụ 2: Cho H2S tác dụng với lượng dư dung dịch KOH thu được dung dịch X. Chất tan có trong dung dịch X là
A. K2S.
B. K2S và KHS.
C. KHS.
D. K2S và KOH.
Hướng dẫn giải
Do KOH dư nên có phản ứng
2KOH + H2S → K2S + 2H2O
Chất tan có trong dung dịch X là K2S và KOH dư.
Đáp án D.
Ví dụ 3: Cho 2,24 lít khí H2S ở đktc phản ứng với dung dịch chứa 0,3 mol KOH. Khối lượng muối tan có trong dung dịch sau phản ứng là
A. 11 gam.
B. 12 gam.
C. 11,5 gam.
D. 10 gam.
Hướng dẫn giải
Có T = 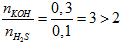
mmuối = 0,1.110 = 11 gam.
Đáp án A.
8. Một số phương trình phản ứng hóa học khác của Kali và hợp chất:
KOH + NH4Cl -to→ KCl+ NH3+ H2O
KOH + NH4NO3 -to→ KNO3+ NH3 + H2O
2KOH + (NH4)2SO4 -to→ K2SO4+ 2NH3 + 2H2O
CH3COOCH3 + KOH -H2O,to→ CH3COOK + CH3OH
CH3COOC2H5 + KOH -H2O,to→ CH3COOK + C2H5OH