Tailieumoi.vn xin giới thiệu đến các quý Thầy/Cô Giáo án Hóa học lớp 12 Bài 17: Ôn tập chương 5 sách Kết nối tri thức theo mẫu Giáo án chuẩn của Bộ GD&ĐT. Hi vọng tài liệu này sẽ giúp Giáo viên dễ dàng biên soạn giáo án Hóa 12. Chúng tôi rất mong sẽ được thầy/cô đón nhận và đóng góp những ý kiến quý báu của mình.
Chỉ từ 500k mua trọn bộ Giáo án Hóa học 12 Kết nối tri thức bản word trình bày đẹp mắt, thiết kế hiện đại (chỉ từ 30k cho 1 bài Giáo án lẻ bất kì):
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank (QR)
B2: Nhắn tin tới zalo Vietjack Official
Xem thử tài liệu tại đây: Link tài liệu
Giáo án Hóa học 12 Bài 17: Ôn tập chương 5
I. MỤC TIÊU
1. Kiến thức
- Hệ thống hoá kiến thức về pin điện và điện phân.
- Hiểu và VDKT về pin điện và điện phân vào thực tiễn sản xuất và cuộc sống
II. THIẾT BỊ DẠY HỌC VÀ HỌC LIỆU
- Sơ đồ Mindmap hệ thống hoá kiến thức về pin điện và điện phân.
- Phiếu học tập.
III. TIẾN TRÌNH DẠY HỌC Hoạt động: Luyện tập
Câu hỏi
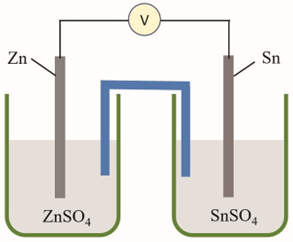
Câu 1. Một pin điện hoá gồm hai điện cực ứng với hai cặp oxi hoá – khử là Sn2+/Sn (Eo = –0,137 V) và Zn2+/Zn (Eo = –0,762 V). Cầu muối chứa KNO3 được dùng để ghép nối hai điện cực.
|
a) Xác định cực âm, cực dương và viết các bán phản ứng ở mỗi điện cực. b) Viết PTHH của phản ứng xảy ra khi pin phóng điện. c) Tính sức điện động chuẩn của pin. d) Trong quá trình phóng điện, ion nào từ cầu muối được chuyển vào dung dịch điện li ở anode? |
 |
Câu 2. Xét phản ứng xảy ra trong một pin điện hoá ở điều kiện chuẩn:
Cu(s) + Fe2(SO4)3(aq) → CuSO4(aq) + 2FeSO4(aq)
a) Viết các bán phản ứng xảy ra ở mỗi điện cực.
b) Mô tả cấu tạo mỗi điện cực của pin điện hoá trên (thanh kim loại làm điện cực; công thức, nồng độ của chất trong dung dịch điện li).
c) Tính sức điện động chuẩn của pin điện hoá trên. (Biết thế điện cực chuẩn của các cặp oxi hoá – khử Cu2+/Cu và Fe3+/Fe2+ lần lượt là 0,340 V và 0,771 V.)
d) Trong quá trình hoạt động, khối lượng thanh kim loại ở mỗi điện cực thay đổi như thế nào?
Câu 3. Xét phản ứng xảy ra trong một pin điện hoá ở điều kiện chuẩn:
Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g)
a) Viết các bán phản ứng xảy ra ở mỗi điện cực.
b) Mô tả cấu tạo mỗi điện cực.
c) Tính thế điện cực chuẩn của cặp Fe2+/Fe, biết sức điện động chuẩn của pin là 0,44 V.
d) Xác định chiều di chuyển của dòng electron ở mạch ngoài.
Hãy chọn đúng hoặc sai cho mỗi ý a, b, c, d ở các câu 4 – 7.
Câu 4. Điện phân dung dịch NaCl 20% với điện cực than chì, có màng ngăn xốp, trước khi nước bắt đầu bị điện phân ở cả hai điện cực thì dừng điện phân.
a) Dung dịch sau điện phân làm phenolphthalein chuyển màu xanh.
b) Thứ tự điện phân ở cathode là Na+, H2O.
c) Số mol khí tạo ra ở anode bằng số mol khí tạo ra ở cathode.
d) Thứ tự điện phân ở anode là Cl−, H2O.
Câu 5. Điện phân dung dịch NaCl bão hoà với điện cực than chì, không có màng ngăn xốp, trước khi nước bắt đầu bị điện phân ở cả hai điện cực thì dừng điện phân.
a) Dung dịch sau điện phân có khả năng diệt khuẩn và tẩy màu.
b) Thứ tự điện phân ở anode là H2O, Cl−.
c) Số mol khí tạo ra ở anode bằng số mol khí tạo ra ở cathode.
d) Thứ tự điện phân ở cathode là H2O, Na+.
|
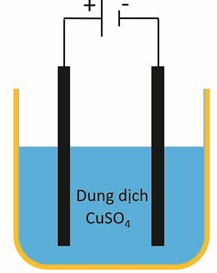
Câu 6. Tiến hành thí nghiệm điện phân dung dịch CuSO4 với hai điện cực bằng than chì, khi dung dịch vẫn còn màu xanh thì dừng điện phân. a) Tại anode xảy ra quá trình khử nước. b) Thứ tự điện phân ở cathode là H2O, Cu2+. c) pH dung dịch điện phân tăng dần trong thời gian điện phân. d) Nồng độ ion Cu2+ giảm dần trong thời gian điện phân. |
 |
Câu 7. Tiến hành thí nghiệm điện phân dung dịch CuSO4 với cathode là chiếc vòng thép và anode là thanh đồng.
a) Tại anode xảy ra quá trình khử đồng.
b) Nồng độ ion Cu2+ gần như không đổi trong thời gian điện phân.
c) Sau điện phân, khối lượng hai điện cực đều giảm so với ban đầu.
d) pH của dung dịch điện li tăng dần trong thời gian điện phân.
Hướng dẫn
Câu 1.
a)
Anode: Zn → Zn2+ + 2e
Cathode: Sn2+ + 2e → Sn
b) Zn + Sn2+ → Zn2+ + Sn
c) Sức điện động chuẩn của pin: Eopin = –0,137 V – (–0,762 V) = 0,625 V.
d) Trong quá trình phóng điện, dung dịch điện li ở anode liên tục có thêm ion Zn2+, khi đó ion NO3– tách ra từ cầu muối để chuyển vào dung dịch để trung hoà điện.
Câu 2.
a)
Anode: Cu → Cu2+ + 2e
Cathode: Fe3+ + 1e → Fe2+
b) Anode: Thanh Cu nhúng vào dung dịch CuSO4 1 M.
Cathode: Thanh Pt nhúng vào dung dịch gồm Fe2(SO4)3 0,5 M và FeSO4 1 M.
c) Sức điện động chuẩn: Eopin = 0,771 V – 0,340 V = 0,431 V.
d) Trong quá trình hoạt động, khối lượng Cu giảm, khối lượng thanh Pt không đổi.
Câu 3.
a)
Anode: Fe → Fe2+ + 2e
Cathode: 2H+ + 2e → H2
b) Anode: Thanh Fe nhúng vào dung dịch FeCl2 1 M.
Cathode: Thanh Pt hấp phụ bão hoà khí H2 (1 bar) nhúng vào dung dịch HCl 1 M.
c) Sức điện động chuẩn:
d) Chiều di chuyển của dòng electron ở mạch ngoài: từ anode sang cathode.
Câu 4.
a) – sai;
b) – sai;
c) – đúng;
d) – đúng.
Câu 5.
a) – đúng;
b) – sai;
c) – sai;
d) – đúng.
Câu 6.
a) – đúng;
b) – sai;
c) – sai;
d) – đúng.
Điện phân dung dịch CuSO4 với anode trơ:
Anode: H2O → 12 O2 + 2H+ + 2e
Cathode: Cu2+ + 2e → Cu
Hiện tượng: anode có khí thoát ra; cathode có đồng màu đỏ tạo thành; pH giảm dần; nồng độ ion Cu2+ giảm dần.
Câu 7.
a) – đúng;
b) – đúng;
c) – sai;
d) – sai.
Điện phân dung dịch CuSO4 với anode Cu tan:
Anode: Cu → Cu2+ + 2e
Cathode: Cu2+ + 2e → Cu
Hiện tượng: anode tan dần; cathode có đồng màu đỏ tạo thành; pH và nồng độ ion Cu2+ gần như không đổi.
................................
................................
................................
Tài liệu có 20 trang, trên đây trình bày tóm tắt 5 trang của Giáo án Hóa học 12 Kết nối tri thức Bài 17: Ôn tập chương 5.
Xem thêm các bài Giáo án Hóa học lớp 12 Kết nối tri thức hay, chi tiết khác:
Giáo án Bài 18: Cấu tạo và liên kết trong tinh thể kim loại
Giáo án Bài 19: Tính chất vật lí và tính chất hoá học của kim loại
Giáo án Bài 20: Kim loại trong tự nhiên và phương pháp tách kim loại
Để mua trọn bộ Giáo án Hóa học lớp 12 Kết nối tri thức năm 2025 mới nhất, mời Thầy/Cô liên hệ Mua tài liệu có đáp án, Ấn vào đây