Lời giải bài tập Hóa học lớp 12 Bài 5: Amine sách Cánh diều hay, chi tiết sẽ giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn Hóa học 12. Mời các bạn đón xem:
Giải bài tập Hóa học 12 Bài 5: Amine
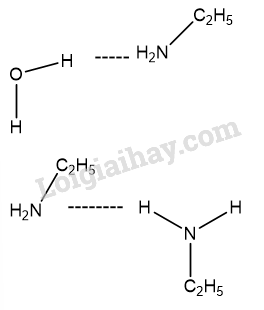
Mở đầu trang 35 Hóa 12: Từ công thức cấu tạo của ammonia và một số amine ở hình 5.1, hãy:
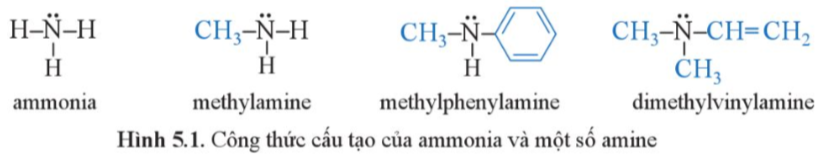
a) Cho biết đặc điểm cấu tạo của amine
b) Giải thích vì sao amine thường có tính base tương tự ammonia
Lời giải:
a) Khi thay thế 1 hay nhiều hydrogen trong phân tử ammonia bằng một hay nhiều gốc hydrocarbon thu được amine
b) Vì các nitrogen trong phân tử amine còn 1 cặp electron tự do gây tính base giống như ammonia
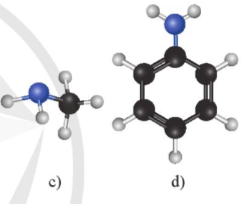
Lời giải:
Đặc điểm cấu tạo phân tử methylamine: gốc – CH3 liên kết với nguyên tử N
Hình dạng phân tử methylamine: hình chóp tam giác
Đặc điểm cấu tạo phân tử aniline: gốc – C6H5 liên kết với nguyên tử N
Hình dạng phân tử aniline: hình tháp nông
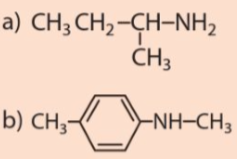
Lời giải:
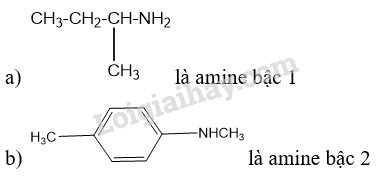
a) Trong các amine trên, amine nào là amine bậc một, bậc hai, bậc ba?
b) Gọi tên các amine trên theo danh pháp thay thế.
Lời giải:
Đồng phân cấu tạo của các amine có công thức phân tử C4H11N:
(1) CH3 – CH2 – CH2 – CH2 – NH2
(2) CH3 – CH(NH2) – CH2 – CH3
(3) (CH3)2CH – CH2 – NH2
(4) (CH3)3C – NH2
(5) CH3 – CH2 – CH2 – NH – CH3
(6) CH3 – CH2 – NH – CH2 – CH3
(7) (CH3)2CH – NH – CH3
(8) CH3 – N(CH3) – CH2 – CH3
a) Các amine bậc 1: (1), (2), (3), (4); amine bậc 2: (5), (6), (7); amine bậc 3: (8)
b)
(1) CH3 – CH2 – CH2 – CH2 – NH2: propan – 1 – amine
(2) CH3 – CH(NH2) – CH2 – CH3: butan – 2 - amine
(3) (CH3)2CH – CH2 – NH2: 2 – methylpropan – 1 – amine
(4) (CH3)3C – NH2: 2 – methylpropan – 2 – amine
(5) CH3 – CH2 – CH2 – NH – CH3: N - methylethanamine
(6) CH3 – CH2 – NH – CH2 – CH3 : N - ethylethanamine
(7) (CH3)2CH – NH – CH3: N – methlypropan – 2 – amine
(8) CH3 – N(CH3) – CH2 – CH3 : N,N – dimethylethanamine
Lời giải:
Thực hành 1 trang 38 Hóa 12: Chuẩn bị:
- Hóa chất: Dung dịch ethylamine 5%, dung dịch HCl đặc, dung dịch CuSO4 5%, dung dịch FeCl3 3%, giấy quỳ tím
- Dụng cụ: Ống nghiệm, đũa thủy tinh, ống hút nhỏ giọt
Tiến hành:
- Cho vào ống nghiệm (1) khoảng 1ml dung dịch ethylamine 5%. Lấy đũa thủy tinh nhúng vào dung dịch rồi chấm vào giấy quỳ tím. Nhúng đũa thủy tinh sạch vào dung dịch HCl đặc rồi đưa đầu đũa thủy tinh vào miệng ống nghiệm (1)
- Cho vào ống nghiệm (2) 5 giọt dung dịch FeCl3 3%. Vừa lắc vừa thêm từ từ đến hết 2ml dung dịch ethylamine 5%
- Cho vào ống nghiệm (3) 5 giọt dung dịch CuSO4 5%. Vừa lắc vừa thêm từ từ đến hết 4ml dung dịch ethylamine 5%.
Yêu cầu: Quan sát, mô tả các hiện tượng và giải thích
Chú ý an toàn: Ethylamine độc, có mùi khó chịu, cần tiến hành thí nghiệm ở nơi thoáng khí hoặc trong tủ hút
Lời giải:
- Ống nghiệm 1: có khói trắng xuất hiện ở đầu ống nghiệm vì ethylamine có phản ứng với HCl đặc
- Ống nghiệm 2: có xuất hiện kết tủa nâu đỏ vì ethylamine phản ứng với FeCl3 tạo ra Fe(OH)3
- Ống nghiệm 3: kết tủa trắng tan dần tạo dung dịch xanh lam
Lời giải:
Trong phân tử aniline có liên kết hydrogen rất yếu nên kém tan trong nước, nhóm chức – NH2 có phản ứng với HCl tạo ra muối tan nên aniline tan được trong dung dịch hydrochloric acid.
Lời giải:
Để khử mùi tanh của cá gây ra bởi hỗn hợp các amine có thể dùng chanh hoặc giấm ăn để khử mùi tanh. Vì các amine có tính base yếu, khi tác dụng với dung dịch acid tạo các muối không có mùi tanh.
Thực hành 2 trang 39 Hóa 12: Chuẩn bị
- Hóa chất: Dung dịch aniline, nước bromine bão hòa
- Dụng cụ: Ống nghiệm, ống hút nhỏ giọt
Tiến hành: Cho vào ống nghiệm 1 ml dung dịch aniline. Thêm tiếp từ từ 0,5 – 1 ml nước bromie, vừa thêm vừa lắc
Yêu cầu: Quan sát và mô tả hiện tượng xảy ra và giải thích
Lời giải:
Hiện tượng: nước bromine nhạt màu dần, và có kết tủa trắng xuất hiện
Giải thích: vì aniline có phản ứng thế ở nhân thơm với nước bromine tạo 2,4,6 – tribromoaniline
Câu hỏi 4 trang 39 Hóa 12: Nêu ứng dụng của amine trong đời sống và sản xuất
Lời giải:
Ứng dụng của amine: để tổng hợp polymer, nguyên liệu để tổng hợp phẩm nhuộm.
Bài tập
Bài 1 trang 41 Hóa 12: Cho các chất có công thức cấu tạo sau:
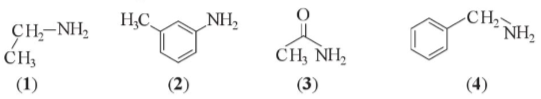
Trong các chất trên, hãy cho biết:
a) Chất nào là amine b) Chất nào thuộc loại arylamine
Lời giải:
a) Amine: (1)
b) Arylamine: (2), (4)
Bài 2 trang 41 Hóa 12: Phát biểu nào dưới đây không đúng?
A. Phân tử ethylamine chứa nhóm chức – NH2
B. Ethylamine tan tốt trong nước
C. Ethylamine tác dụng với nitrous acid thu được muối diazonium
D. Dung dịch ethylamine trong nước làm quỳ tím hóa xanh
Lời giải:
A. đúng
B. đúng
C. sai, ethylamine tác dụng với nitrous acid thu được ethanol và giải phóng nitrogen
D. đúng
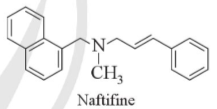
a) Cho biết nafitifine thuộc loại amine bậc một, bậc hai hay bậc ba
b) Vì sao trong phân tử nafitifine có vòng benzene nhưng naftifine không thuộc loại arylamine?
c) Naftifine thường được dùng ở dạng muối naftifine hydrochloride. Viết phương trình hóa học của phản ứng tạo thành naftifine hydrochloride từ naftifine và hydrochoric acid.
Lời giải:
a) Naftifine thuộc amine bậc ba
b) Vì vòng benzene không liên kết trực tiếp với nguyên tử nitrogen
c) 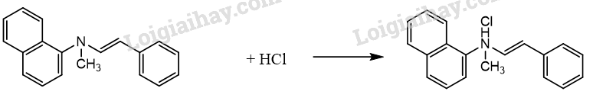
Bài 4 trang 41 Hóa 12: Cho chuỗi chuyển hóa sau:
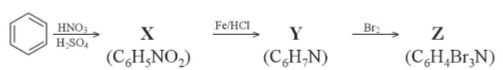
Cho biết công thức cấu tạo của các chất X, Y, Z trong chuỗi chuyển hóa trên và viết các phương trình hóa học thực hiện chuỗi chuyển hóa.
Lời giải:
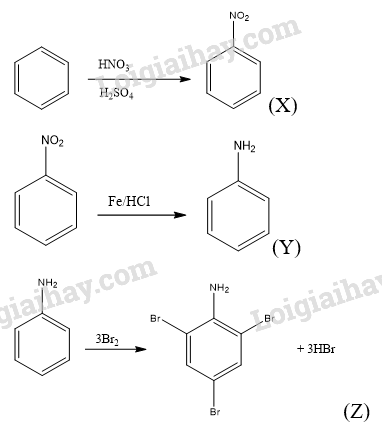
Lý thuyết Amine
I. Khái niệm, phân loại và danh pháp
1. Khái niệm
Khi thay thế một hay nhiều nguyên tử hydrogen trong phân tử ammonia bằng một hay nhiều gốc hydrocarbon thu được amine.
2. Phân loại
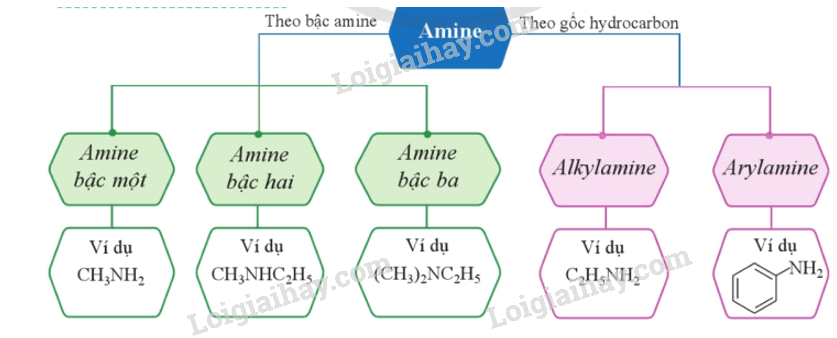
3. Danh pháp
Theo danh pháp gốc – chức, tên của amine được hình thành từ tên của các gốc hydrocarbon liên kết trực tiếp với nguyên tử nitrogen kèm theo tên chức amine
Theo danh pháp thay thế, các amine đơn chức được gọi tên như sau:
+ Amine bậc một: tên hydrocarbon (bỏ e) + vị trí nhóm –NH2 + amine
+ Amine bậc hai: N – tên gốc hydrocarbon + tên hydrocarbon mạch dài nhất (bỏ e) + vị trí nhóm chức amine + amine
+ Amine bậc ba: N – tên gốc hydrocarbon thứ nhất + N – tên gốc hydrocarbon thứ hai + tên hydrocarbon mạch dài nhất (bỏ e) + vị trí nhóm chức amine + amine.
II. Tính chất vật lý
- Methylamine, dimethylamine, trimethylamine và ethylamine là những chất khí ở điều kiện thường. Các amine có phân tử phối lớn hơn là chất lỏng hoặc chất rắn.
- Các amine có khối lượng phân tử thấp thường có mùi khó chịu
- Amine thường có nhiệt độ sôi cao hơn so với nhiệt độ sôi của các hydrocarbon có cùng số nguyên tử carbon hoặc có phân tử khối gần với chúng
III. Tính chất hóa học
1. Tính base và phản ứng tạo phức
- Dung dịch aniline trong nước không làm đổi màu quỳ tím, trong khi dung dịch các alkylamine có thể làm quỳ tím hóa xanh. Amine tác dụng với acid tạo thành muối. Các amine có khối lượng phân tử nhỏ có khả năng tác dụng với dung dịch muoói của một số kim loại tạo thành kết tủa hydroxide.
Ví dụ: C2H5NH2 + HCl [C2H5NH3]+Cl-
3C2H5NH2 + FeCl3 + 3H2OFe(OH)3 + 3[C2H5NH3]+Cl-
2. Tính khử
Alkylamine bậc một tác dụng với nitrous acid ở nhiệt độ thường tạo thành alcohol và giải phóng nitrogen
Ví dụ: C2H5NH2 + HONO C2H5OH + N2 + H2O
3. Phản ứng thế ở nhân thơm của aniline
Nhóm – NH2 trong phân tử aniline làm tăng mật độ electron trong vòng benzene, đặc biệt ở các vị trí ortho và para. Aniline dễ tham gia phản ứng với nước bromine tạo 2,4,6 – tribromoaniline kết tủa trắng.
IV. Ứng dụng và điều chế
1. Ứng dụng
- Hợp chất có nhóm chức amine được thấy trong thành phần của nhiều dược phẩm, thuốc bảo vệ thực vật,…
- Aniline là nguyên liệu quan trọng để tổng hợp phẩm nhuộm, chất hoạt động bề mặt.
2. Điều chế
a) Alkyl hóa ammonia
alkylamine được điều chế từ ammonia và dẫn xuất halogen.
Ví dụ: 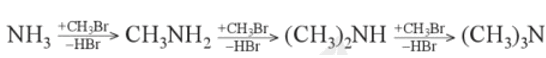
b) Khử hợp chất nitro
Arylamine thường được điều chế bằng cách khử dẫn xuất nitro tương ứng. Tác nhân khử thường dùng là kim loại trong hydrochloric acid
Ví dụ: 
Sơ đồ tư duy Amine

Xem thêm các bài giải bài tập Hóa Học lớp 12 Cánh diều hay, chi tiết khác:
Bài 4. Tính chất hoá học của carbohydrate
Bài 7. Peptide, protein và enzyme