Tailieumoi.vn giới thiệu Giải bài tập Khoa học tự nhiên lớp 9 Bài 24: Alkene chi tiết sách Kết nối tri thức giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập môn KHTN 9. Mời các bạn đón xem:
Giải bài tập KHTN 9 Bài 24: Alkene
Trả lời:
- Ethylene thuộc loại hợp chất hữu cơ là alkene.
- Ethylene là hydrocarbon mạch hở, trong phân tử có một liên kết đôi.
- Tính chất của ethylene:
+ Phản ứng cháy: tỏa ra nhiều nhiệt.
C2H4 + 3O2 2CO2 + 2H2O
+ Phản ứng cộng: làm mất màu nước bromine.
CH2=CH2 + Br-Br → Br-CH2-CH2-Br
+ Phản ứng trùng hơp:
nCH2=CH2
- Vai trò trong công nghiệp hóa chất:
+ Tổng hợp ethylic alcohol.
+ Sản xuất dung môi.
+ Tổng hợp acetic acid.
+ Sản xuất polyethylene (PE), poly(vinyl chloride) (PVC).
I. Khái niệm alkene
Hoạt động trang 111 KHTN 9: Cho công thức cấu tạo của một số alkene như sau:
|
CH2 = CH2 |
CH3 – CH = CH2 |
CH3 – CH = CH – CH3 |
Thực hiện các yêu cầu sau:
1. Nhận xét về đặc điểm chung của các công thức cấu tạo đã cho.
2. Viết công thức phân tử của các alkene trên, từ đó rút ra công thức chung của các alkene đó.
Trả lời:
1. Các công thức cấu tạo trên đều mạch hở, có một liên kết C = C
2. Công thức phân tử của các alkene trên lần lượt là: C2H4; C3H6; C4H8.
→ Công thức chung của các alkene là: CnH2n (n ≥ 2).
II. Ethylene
Hoạt động trang 112 KHTN 9: Thí nghiệm: Điều chế và thử tính chất của ethylene
Chuẩn bị: bình cầu có nhánh 250 mL đựng dung dịch cồn 96° và dung dịch H2SO4 đặc đã được trộn đều, đá bọt, ống nghiệm chứa khoảng 2 mL nước bromine, bình thuỷ tinh chứa dung dịch NaOH, ống dẫn thuỷ tinh đầu vuốt nhọn, ống dẫn thuỷ tinh hình chữ L.
Dụng cụ thí nghiệm được lắp sẵn như Hình 24.1.
Tiến hành:
- Đun nóng bình cầu đến khi khí ethylene sinh ra và đi vào ống dẫn thuỷ tinh có đầu vuốt nhọn. Dùng que đóm đang cháy để đốt ethylene ở đầu vuốt nhọn của ống dẫn.
- Thay ống dẫn thuỷ tinh đầu vuốt nhọn bằng ống dẫn thuỷ tinh hình chữ L và dẫn khí ethylene vào ống nghiệm đựng nước bromine.
Thực hiện các yêu cầu sau:
Quan sát hiện tượng xảy ra ở đầu ống dẫn thuỷ tinh vuốt nhọn và tại ống nghiệm đựng nước bromine. Rút ra nhận xét về tính chất hoá học của ethylene
Trả lời:
Hiện tượng: Que đóm cháy mãnh liệt hơn. Khi sục khí ethylene vào ống nghiệm đựng nước bromine thấy màu của dung dịch nước bromine nhạt dần rồi mất màu.
→ Ethylene có phản ứng cháy và tác dụng với bromine.
C2H4 + 3O2 2CO2 + 2H2O
H2C = CH2 + Br2 → BrH2C – CH2Br
Trả lời:
Propylene có tính chất hóa học tương tự ethylene vì propylene cũng có mạch hở và có liên kết đôi trong cấu tạo giống với ethylene.
Phương trình hoá học minh hoạ:
2C3H6 + 9O2 6CO2 + 6H2O
CH3 – CH = CH2 + Br2 → CH3 – CH(Br) – CH2Br
Trả lời:
Ethylene là nguyên liệu quan trọng cho ngành công nghiệp sản xuất hóa chất và tổng hợp polymer. Một số ứng dụng có thể kể đến như:
* Tổng hợp ethylic alcohol: C2H4 có liên kết đôi nên ở nhiệt độ thích hợp và có xúc tác acid, ethylene có thể cộng nước tạo thành ethylic alcohol (C2H5OH).
PTHH: C2H4 + H2O C2H5OH
* Tổng hợp acetic acid: có nhiều cách để tổng hợp từ ethylene ra acetic acid, một trong những cách đó là tổng hợp ethylene thu được ethylic alcohol rồi cho ethylic alcohol tiếp xúc không khí sẽ thu được acetic acid.
PTHH: C2H5OH + O2 CH3COOH + H2O
* Kích thích quả mau chín: Ethylene làm cho trái cây mau chín đó là do ethylene là một trong những chất tham gia vào quá trình làm chín trái cây trong tự nhiên. Ethylene là một hormone thực vật ở dạng khí, hormone này được hình thành ngay từ trong cây, ethylene kích thích sự hô hấp của tế bào trái cây làm già hóa cho quả xanh mau chín.
* Sản xuất dung môi: Ethylene thường đường làm nguyên liệu chính để tổng hợp các dung mỗi hữu cơ như ethylic alcohol, ethylene glycol,…
PTHH: CH2=CH2 + 4H2O + 2KMnO4 → 3HO-CH2-CH2-OH + 2MnO2 + 2KOH
* Sản xuất polyethylene (PE), poly(vinyl chloride)(PVC)
Ethylene (nhựa PE) được sản xuất bằng cách trùng hợp ethylene.
PTHH: nCH2=CH2
Xem thêm các bài giải bài tập Khoa học tự nhiên 9 Kết nối tri thức hay, chi tiết khác:
Lý thuyết KHTN 9 Bài 24: Alkene
I. Khái niệm alkene
- Alkene là những hydrocarbon mạch hở, trong phân tử có một liên kết đôi
Ví dụ: CH3 – CH = CH2, CH3 – CH = CH – CH3,….
- Công thức chung của các alkene có dạng CnH2n (với , n là số nguyên, dương).
II. Ethylene
1. Tính chất vật lí
Ethylene là chất khí ở điều kiện thường, không màu, hầu như không tan trong nước, tan ít trong các dung môi hữu cơ như ethylic alcohol.
2. Cấu tạo phân tử
- Công thức phân tử của ethylene là C2H4.
- Công thức cấu tạo của ethylene là
Phân tử ethylene có liên kết đôi 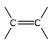
3. Tính chất hoá học
a) Phản ứng cháy
Phản ứng đốt cháy các alkene tạo ra sản phẩm chủ yếu là khí carbon dioxide và hơi nước. Phản ứng toả ra nhiều nhiệt.
b) Phản ứng cộng
- Trong phản ứng của ethylene với nước bromine, phân tử ethylene đã làm mất màu nước bromine, liên kết kém bền trong liên kết đôi bị phá vỡ.
- Phản ứng:
Viết gọn lại là: C2H4 + Br2 → C2H4Br2
Phản ứng này được gọi là phản ứng cộng.
c) Phản ứng trùng hợp
- Ở điều kiện thích hợp, các phân tử ethylene cộng hợp liên tiếp với nhau, liên kết kém bền trong liên kết đôi của phân tử ethylene bị phá vỡ, tạo thành chất có khối lượng phân tử lớn.
Phản ứng này được gọi là phản ứng trùng hợp.
- Polyethylene (nhựa PE) là chất rắn, không tan trong nước, không độc, được dùng để sản xuất túi đựng, màng bọc, chai, bình chứa,… Tuy nhiên, nhựa PE rất khó phân huỷ sinh học, có thể tồn tạo bền trong môi trường hàng trăm năm, vì vậy cần giảm việc thải các sản phẩm làm từ nhựa PE ra ngoài môi trường.
4. Ứng dụng
Ethylene là nguyên liệu quan trọng cho ngành công nghiệp sản xuất hoá chất và tổng hợp polymer:
- Tổng hợp acetic acid;
- Tổng hợp ethyl alcohol;
- Sản xuất dung môi;
- Kích thích quả mau chín;
- Sản xuất polyethylene (PE); poly(vinyl chloride) (PVC).