Tailieumoi.vn giới thiệu Giải bài tập Hóa học 9 Bài 17: Dãy hoạt động hóa học của kim loại chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Dãy hoạt động hóa học của kim loại lớp 9
Giải bài tập Hóa học lớp 9 Bài 17: Dãy hoạt động hóa học của kim loại
Câu hỏi và bài tập (trang 54 sgk Hóa học lớp 9)
a) K, Mg, Cu, Al, Zn, Fe ;
b) Fe, Cu, K, Mg, Al, Zn ;
c) Cu, Fe, Zn, Al, Mg, K ;
d) Zn, K, Mg, Cu, Al, Fe ;
e) Mg, K, Cu, Al, Fe.
Phương pháp giải:
Ghi nhớ dãy hoạt động hóa học của kim loại
K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au
Đi từ trái sang phải tính kim loại (hoạt động hóa học) giảm dần
Lời giải:
Dãy các kim loại được sắp xếp theo đúng chiều hoạt động hóa học tăng dần là:
Cu, Fe, Zn, Al, Mg, K
a) Fe ; b) Zn ; c) Cu ; d) Mg.
Lời giải:
Dùng kẽm vì có phản ứng
Zn + CuSO4 → ZnSO4 + Cu↓
Nếu dùng dư Zn, Cu tạo thành không tan được tách ra khỏi dung dịch và thu được dung dịch tinh khiết
a) Điều chế CuSO4 từ Cu.
b) Điều chế MgCl2 từ mỗi chất sau : Mg, MgSO4, MgO, MgCO3.
(Các hoá chất cần thiết coi như có đủ).
Lời giải:
Phương trình hóa học:
a) Điều chế CuSO4 từ Cu:
+ Cách 1: Cu + 2H2SO4 đặc, nóng → CuSO4 + SO2 + 2H2O
+ Cách 2:
b) Điều chế MgCl2 :
- Từ Mg: Mg + 2НСl → MgCl2 + H2
- Từ MgSO4 : MgSO4 + BaCl2 → MgCl2 + BaSO4
- Từ MgO: MgO + 2HCl → MgCl2 + H2O
- Từ MgCO3:
a) kẽm vào dung dịch đồng clorua.
b) đồng vào dung dịch bạc nitrat.
c) kẽm vào dung dịch magie clorua.
d) nhôm vào dung dịch đồng clorua.
Viết các phương trình hoá học, nếu có.
Lời giải:
Hiện tượng xảy ra khi cho:
a) Kẽm vào dung dịch đồng clorua: CuCl2(dd) + Zn(r) → ZnCl2(dd) + Cu(r)
Hiện tượng: Mẩu Zn tan dần, có chất rắn màu đỏ bám vào bề mặt kẽm, màu xanh của dung dịch nhạt dần
b) Đồng vào dung dịch bạc nitrat: Cu +2 AgNO3 → Cu(NO3)2 + 2Ag ↓
Hiện tượng: Cu tan dần, chất rắn màu trắng bám vào bề mặt đồng. Đồng đẩy được Ag ra khỏi dung dịch muối, màu xanh lam xuất hiện trong dung dịch
c) Kẽm vào dung dịch magie clorua: Không có hiện tượng xảy ra và không có phản ứng.
d) Nhôm vào dung dịch đồng clorua: 2Al(r) + 3CuCl2(dd) → 2AlCl3 + 3Cu(r)
Hiện tượng: Al tan dần, có chất rắn màu đỏ bám vào bề mặt nhôm, màu xanh của dung dịch nhạt dần.
a) Viết phương trình hoá học.
b) Tính khối lượng chất rắn còn lại sau phản ứng.
Phương pháp giải:
Đổi số mol H2 = V/ 22,4 = ?
a) PTHH: Zn + H2SO4 → ZnSO4 + Н2 ↑
Từ PTHH, tính số mol Zn theo số mol Н2
b) Vì Cu không phản ứng với HCl nên chất rắn sau phản ứng là Cu
mCu = mhh - mZn =?
Lời giải:
Số mol khí H2 thoát ra = 2,24 : 22,4 = 0,1 mol.
a) Phương trình hóa học: Zn + H2SO4 → ZnSO4 + Н2
Cu đứng sau H trong dãy hoạt động hóa học nên không phản ứng với dung dịch loãng
b) Theo phương trình: số mol Zn phản ứng = 0,1 mol hay 6,5 gam
Khối lượng chất rắn (Cu) còn lại sau phản ứng = mhh - mZn = 10,5 - 0,1 x 65 = 4 gam
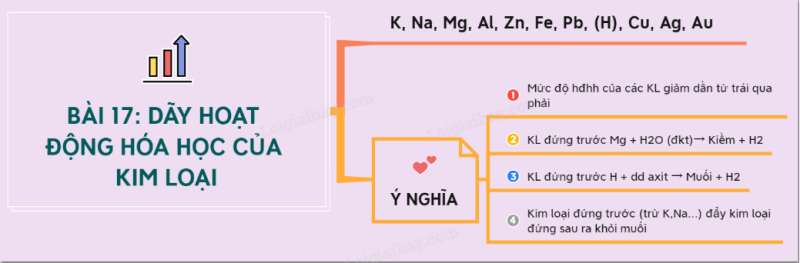
I. Dãy hoạt động hóa học của kim loại
- Dãy hoạt động hóa học của kim loại là dãy các kim loại được sắp xếp theo chiều giảm dần mức độ hoạt động hóa học của chúng.
- Dãy hoạt động của một số kim loại:

* Mẹo nhớ: Khi (K) bà (Ba) con (Ca) nào (Na) may (Mg) áo (Al) giáp (Zn) sắt (Fe) nhớ (Ni) sang (Sn) phố (Pb) hỏi (H) cửa (Cu) hàng (Hg) á (Ag) phi (Pt) âu (Au)
II. Ý nghĩa của dãy hoạt động hóa học của kim loại
a) Mức độ hóa học của các kim loại giảm dần từ trái sang phải
=> K là kim loại hoạt động mạnh nhất và Au là kim loại hoạt động kém nhất.
b) Kim loại đứng trước Mg (K, Ba, Ca, Na) phản ứng được với nước ở nhiệt độ thường.
2Na + 2H2O → 2NaOH + H2↑
Ba + 2H2O → Ba(OH)2 + H2↑
c) Kim loại đứng trước H tác dụng với dung dịch axit (HCl; H2SO4loãng,….) tạo ra H2
Fe + 2HCl → FeCl2 + H2 ↑
Cu + 2HCl → không phản ứng (vì Cu đứng sau H)
d) Kim loại không tan trong nước (từ Mg trở về sau) đẩy được kim loại đứng sau nó ra khỏi dung dịch muối
Fe + CuSO4 → FeSO4 + Cu
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Chú ý: Khi cho Na vào dung dịch CuCl2 thì:
+ Na phản ứng với nước trước: 2Na + 2H2O → 2NaOH + H2↑
+ Sau đó xảy ra phản ứng: CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Sơ đồ tư duy: Dãy hoạt động hoá học của kim loại