Tailieumoi.vn giới thiệu Giải bài tập Hóa học 9 Bài 16: Tính chất hóa học của kim loại chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Tính chất hóa học của kim loại lớp 9
Giải bài tập Hóa học lớp 9 Bài 16: Tính chất hóa học của kim loại
Câu hỏi và bài tập (trang 51 sgk Hóa học lớp 9)
Bài 1 trang 51 sgk hoá học 9: Kim loại có những tính chất hoá học nào? Lấy thí dụ và viết các phương trình hoá học minh hoạ với kim loại magie.
Phương pháp giải:
Kế tên các tính chất hóa học của kim loại sau đó viết PTHH
1. Tác dụng với phi kim
2. Tác dụng với dung dịch axit
3. Tác dụng với dung dịch muối.
Lời giải:
Kim loại có các tính chất hóa học là:
- Tác dụng với phi kim
Thí dụ: 2Mg +O2 2MgO (đk :to)
- Tác dụng với phi kim khác
Thí dụ: Mg + Cl2 MgCl2
- Tác dụng với dung dịch axit
Thí dụ: Mg +2 HCl → MgCl2 + H2↑
- Tác dụng với dung dịch muối
Thí dụ: Mg + CuSO4 → MgSO4 + Cu ↓
Bài 2 trang 51 sgk hoá học 9: Hãy viết các phương trình hoá học theo các sơ đồ phản ứng sau đây :
a) .......... + HCl MgCl2 + H2;
b) ......... + AgNO3 Cu(NO3)2 + Ag;
c) ......... + ............ ZnO;
d) ........ + Cl2 CuCl2
e) ....... + S —> K2S.
Lời giải:
a) Mg + 2HCl → MgCl2 + H2 ↑
b) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
c) 2Zn + O2 2ZnO ;
d) Cu + Cl2 CuCl2
e) 2K + S K2S.
a) Kẽm + Axit sunturic loãng ; b) Kẽm + Dung dịch bạc nitrat;
c) Natri + Lưu huỳnh ; d) Canxi + Clo.
Phương pháp giải:
a) Kim loại + Axit → Muối + H2 ↑
b) Kim loại + Muối → Muối mới + Kim loại mới
c) Kim loại + Phi kim (trừ O2) → Muối
d) Kim loại + Phi kim (trừ O2) → Muối
Lời giải:
Các phương trình hóa học
a) Zn + H2SO4 → ZnSO4 + H2 ↑
b) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag ↓
c) 2Na + S → Na2S
d) Ca + Cl2 CaCl2
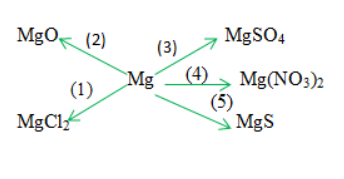
Lời giải:
1) Mg +Cl2 MgCl2
2) 2Mg + O2 2MgO
3) Mg + H2SO4 loãng → MgSO4 +H2↑
4) Mg + 2AgNO3 → Mg(NO3)2 + 2Ag↓
5) Mg + S → MgS↓
a) Đốt dây sắt trong khí clo.
b) Cho một đinh sắt vào ống nghiệm đựng dung dịch CuCl2.
c) Cho một viên kẽm vào dung dịch CuS04.
Lời giải:
a) Hiện tượng: Sắt bị nóng chảy, bắn thành các hạt sáng đồng thời thu được FeCl3 có màu đỏ nâu
2Fe + 3Cl2 2FeCl3
b) Hiện tượng: thanh sắt tan dần, có kim loại màu đỏ sinh ra bám vào đinh sắt đồng thời dung dịch màu xanh lam nhạt màu dần.
Fe + CuCl2 → FeCl2 + Cu↓ (màu đỏ)
c) Hiện tượng: Viên kẽm tan dần đến hết, màu xanh của dung dịch CuSO4 nhạt màu dần đồng thời xuất hiện kim loại màu đỏ
Zn + CuSO4 → ZnSO4 + Cu↓ (đỏ)
Phương pháp giải:
Đổi số mol CuSO4
Viết PTHH: Zn + CuSO4 —> ZnSO4 + Cu ↓
Đặt số mol Zn, ZnSO4 và Cu theo số mol của CuSO4
Tính: m dd sau phản ứng = mddCuSO4 + mZn – m Cu giải phóng
=> C% ZnSO4 = ?
Lời giải:
Zn + CuSO4 ZnSO4 + Cu
1 mol 1 mol 1 mol 1 mol
? 0,0125 mol ?
Theo phương trình:
Theo phương trình:
Ta có:
mdd sau pứ =
Phương pháp giải:
Sử dụng phương pháp tăng giảm khối lượng
Gọi số mol của Cu phản ứng là x (mol)
Viết PTHH: Cu + 2AgNO3 —> Cu(NO3)2 + 2Ag ↓
x —> 2x —> x —> 2x
Khối lượng kim loại tăng = mAg sinh ra - mCu phản ứng
=> 2x.108 - 64x = 1,52
=> x = ?
=> Tính toán được các yêu cầu bài toán
Lời giải:
Phương trình hóa học:
Gọi số mol Cu phản ứng là x
Theo phương trình ta có: nAg sinh ra = 2nCu phản ứng = 2x mol
Khối lượng lá đồng tăng thêm là 1,52 gam mAg sinh ra – mCu phản ứng = 1,52
108.2x – 64x = 1,52 x = 0,01
Theo phương trình hóa học
Nồng độ dung dịch AgNO3:
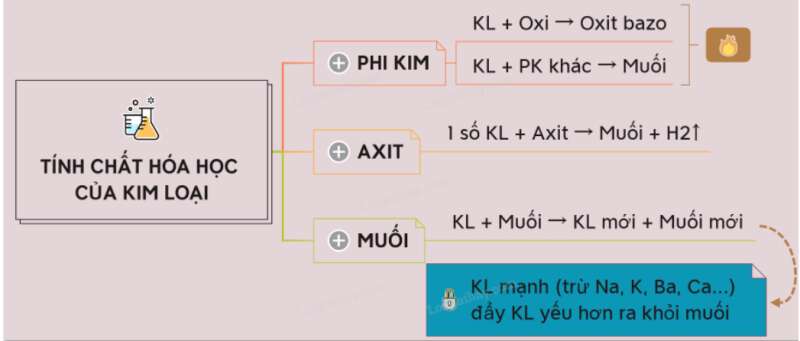
I. Tác dụng với phi kim
1. Tác dụng với oxi
2Mg + O2 2MgO
3Fe + 2O2 Fe3O4
* Kết luận: Hầu hết các kim loại (trừ Ag, Au, Pt) phản ứng với oix ở nhiệt độ thường hoặc nhiệt độ cao tạo thành oxit.
2. Tác dụng với phi kim khác
- Tác dụng với Cl2: tạo muối clorua (kim loại có hóa trị cao nhất)
Cu + Cl2 CuCl2
2Fe + 3Cl2 2FeCl3
Nếu Fe dư: Fedư + 2FeCl3 3FeCl2
- Tác dụng với lưu huỳnh: khi đun nóng tạo muối sunfua (trừ Hg xảy ra ở nhiệt độ thường)
Fe + S FeS
Hg + S → HgS
=> Ứng dụng: dùng lưu huỳnh để thu hồi thủy ngân khi ống nhiệt kế bị vỡ
II. Tác dụng với dung dịch axit
1. Tác dụng với dung dịch HCl và H2SO4 loãng (trừ Cu, Ag, Au, Pt)
Fe + HCl → FeCl2 + H2
Zn + H2SO4 loãng → ZnSO4 + H2
2. Tác dụng với axit H2SO4 đặc nóng và HNO3 đặc nóng
2Ag + H2SO4 đặc Ag2SO4 + SO2 ↑ + 2H2O
2Al + 6H2SO4 đặc Al2(SO4)3 + 3SO2↑ + 6H2O
Lưu ý: Al, Fe, Cr không tác dụng với H2SO4 đặc nguội
III. Tác dụng với dung dịch muối
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Nhận xét: Cu hoạt động hóa học mạnh hơn Ag
Fe + CuSO4 → FeSO4 + Cu
Nhận xét: Fe hoạt động hóa học mạnh hơn Cu
=> Hoạt động hóa học của Fe > Cu > Ag
KẾT LUẬN: Kim loại hoạt động hóa học mạnh hơn (trừ Na, K, Ca, Ba…) có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới.
Sơ đồ tư duy: Tính chất hoá học của kim loại
Một số lưu ý cần nhớ
1. Tác dụng với phi kim
a) Tác dụng với oxi: Hầu hết kim loại (trừ Au, Pt, Ag,...) tác dụng với oxi ở nhiệt độ thường hoặc nhiệt độ cao, tạo thành oxit.
VD: 2Cu + O2 → 2CuO
b) Tác dụng với phi kim khác (Cl,S,...): Nhiều kim loại tác dụng với nhiều phi kim, tạo thành muối.
VD: Hg + S → HgS
2. Tác dụng với dung dịch axit
Nhiều kim loại tác dụng với dung dịch axit (HCl,...) tạo thành muối và H2.
Fe + 2HCl → FeCl2 + H2
Mg + H2SO4 → MgSO4 + H2
3. Tác dụng với dung dịch muối
Kim loại hoạt động mạnh hơn (trừ Na, K, Ba,...) tác dụng với muối của kim loại yếu hơn, tạo thành muối và kim loại mới.
Mg + CuSO4 → MgSO4 + Cu
Dạng 1: Lý thuyết về tính chất hóa học của kim loại
* Một số ví dụ điển hình
Ví dụ 1: Có các phản ứng sau:
a. HCl + (A) → MgCl2 + H2
b. AgNO3 + (B) → Cu(NO3)2 + Ag
c. S + (C) → K2S
d. (D) + Cl2 → ZnCl2
(A), (B), (C), (D) lần lượt là:
A. KCl, MgO, CuO,ZnO
B. Zn, Mg, K,Cu
C. Mg, Cu, K,Zn
D. MgO, CuO, KCl,ZnO
Hướng dẫn giải chi tiết:
HCl + (A) → MgCl2 + H2 => A là Mg
AgNO3 + (B) → Cu(NO3)2 + Ag => B là Cu
S + (C) → K2S => C là K
(D) + Cl2 → ZnCl2 => D là Zn
Đáp án C
Ví dụ 2: Chọn câu đúng nhất khi nói đến tính chất hóa học của kim loại
A. Dãy gồm các kim loại Mg, Al, Zn, Cu khi tác dụng với oxi (ở điều kiện thường) sẽ tạo thành các oxit bazơ tương ứng với nó.
B. Kim loại hoạt động hóa học mạnh hơn (trừ Na, K, Mg, Ca) có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới.
C. Hầu hết tất cả các kim loại có thể phản ứng với dung dịch axit HCl hoặc H2SO4 loãng để giải phóng khí hiđro và sinh ra muối.
D. Ở nhiệt độ cao, các kim loại như Cu, Mg, Fe…phản ứng với lưu huỳnh tạo thành sản phẩm là muối sunfua tương ứng là CuS, MgS, FeS.
Hướng dẫn giải chi tiết
A. sai vì kim loại Mg, Al, Zn, Cu khi tác dụng với oxi (ở điều kiện thích hợp) sẽ tạo thành các oxit bazơ tương ứng với nó.
B. Sai vì từ kim loại Mg trở về sau trong dãy điện hóa thì kim loại mạnh hơn đẩy kim loại yếu hơn ra khỏi muối
C. Sai vì phải là các kim loại đứng trước H trong dãy điện hóa mới phản ứng được với dd HCl và H2SO4 loãng sinh ra khí hiđro và muối.
Đáp án D
Ví dụ 3: Cho hỗn hợp bột gồm: Al, Fe, Mg và Cu vào dung dịch HCl dư, sau phản ứng thu được chất rắn T không tan. Vậy T là:
A. Al
B. Fe
C. Mg
D. Cu
Hướng dẫn giải chi tiết
Cu là kim loại đứng sau H trong dãy điện hóa nên không tan trong dd HCl => chất rắn T là Cu
Đáp án D
Dạng 2: Bài toán kim loại tác dụng với phi kim
* Một số ví dụ điển hình
Ví dụ 1: Đốt cháy hoàn toàn 1,35g nhôm trong oxi. .Khối lượng nhôm oxit tạo thành và khối lượng oxi đã tham gia phản ứng là:
Hướng dẫn giải chi tiết:
nAl = mAl : MAl = 1,35 : 27 = 0,05 mol
PTHH: 4Al + 3O2 → 2Al2O3
Tỉ lệ: 4 3 2
Pứ: 0,05 ? ?mol
Theo pthh ta có nO2 = ¾ . nAl = 3/4 . 0,05 = 0,0375 mol
=> mO2 = nO2 . MO2 = 0,0375 . 32 = 1,2g
nAl2O3 = ½ nAl = 0,025 mol
=> mAl2O3 = nAl2O3 . MAl2O3 = 0,025 . (27 . 2 + 48) = 2,55g
Ví dụ 2: Đốt nhôm trong bình khí Clo . Sau phản ứng thấy khối lượng chất rắn trong bình tăng 7,1g . Khối lượng nhôm đã tham gia phản ứng là :
Hướng dẫn giải chi tiết:
2Al + 3Cl2 → 2AlCl3
Dễ thấy m chất rắn tăng = mCl2 = 7,1g
=> nCl2 = 0,1 mol
nAl = 2/3 nCl2 = 1/15 mol
=> mAl = nAl . MAl = 1/15 . 27 = 1,8g
Dạng 3: Bài toán kim loại tác dụng với axit
* Một số ví dụ điển hình:
Ví dụ 1: Cho 6,5 gam Zn vào dung dịch HCl dư. Hỏi thể tích khí thu được từ phản ứng ở đktc là bao nhiêu? (cho Zn = 65)
Hướng dẫn giải chi tiết:
PTPƯ: Zn + 2HCl → ZnCl2 + H2↑
0,1 → 0,1 (mol)
VH2(đktc) = 0,1 × 22,4 = 2,24 (lít)
Ví dụ 2: Cho 1,08 gam kim loại R vào dung dịch H2SO4 loãng dư. Lọc dung dịch, đem cô cạn thu được 6,84 gam một muối khan duy nhất. Kim loại R là:
Hướng dẫn giải chi tiết:
Gọi kim loại R có hóa trị n (n = 1, 2, 3, 4)
2R + nH2SO4 → R2(SO4)n + nH2
Ta có:
Theo phản ứng:
=> R = 9n
R là kim loại nên n có thể nhận các giá trị là : 1, 2, ,3
=> n = 3 và R = 27 sẽ thỏa mãn
R là Al
Dạng 4: Kim loại tác dụng với dung dịch muối
* Một số ví dụ điển hình
Ví dụ 1: Nhúng một thanh sắt vào dung dịch CuSO4, sau một thời gian thấy khối lượng chất rắn tăng 1,6 gam. Số mol CuSO4 đã tham gia phản ứng là:
Hướng dẫn giải chi tiết:
Gọi số mol của CuSO4 phản ứng là x (mol)
PTPƯ: Fe + CuSO4 → FeSO4 + Cu↓
x ← x → x (mol)
Khối lượng tăng: mtăng = mCu - mFe
=> 1,6 = 64x – 56x
=> 1,6 = 8x
=> x = 0,2 (mol)
Ví dụ 2: Nhúng 1 thanh Al nặng 50 gam vào 400ml dung dịch CuSO4 0,5M. Sau một thời gian, lấy thanh Al ra cân nặng 51,38 gam. Khối lượng Cu đã giải phóng là:
Hướng dẫn giải chi tiết:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
PT: 2 mol 3 mol
→ m thanh Al tăng = 3.64 - 2.27 = 138 gam
ĐB: 0,02 mol 0,03 mol
=> m thanh Al tăng = 1,38 gam
→ mCu = 0,03.64 = 1,92g