Với tóm tắt lý thuyết Khoa học tự nhiên lớp 8 Bài 10: Oxide sách Kết nối tri thức hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn KHTN 8.
Khoa học tự nhiên 8 Bài 10: Oxide
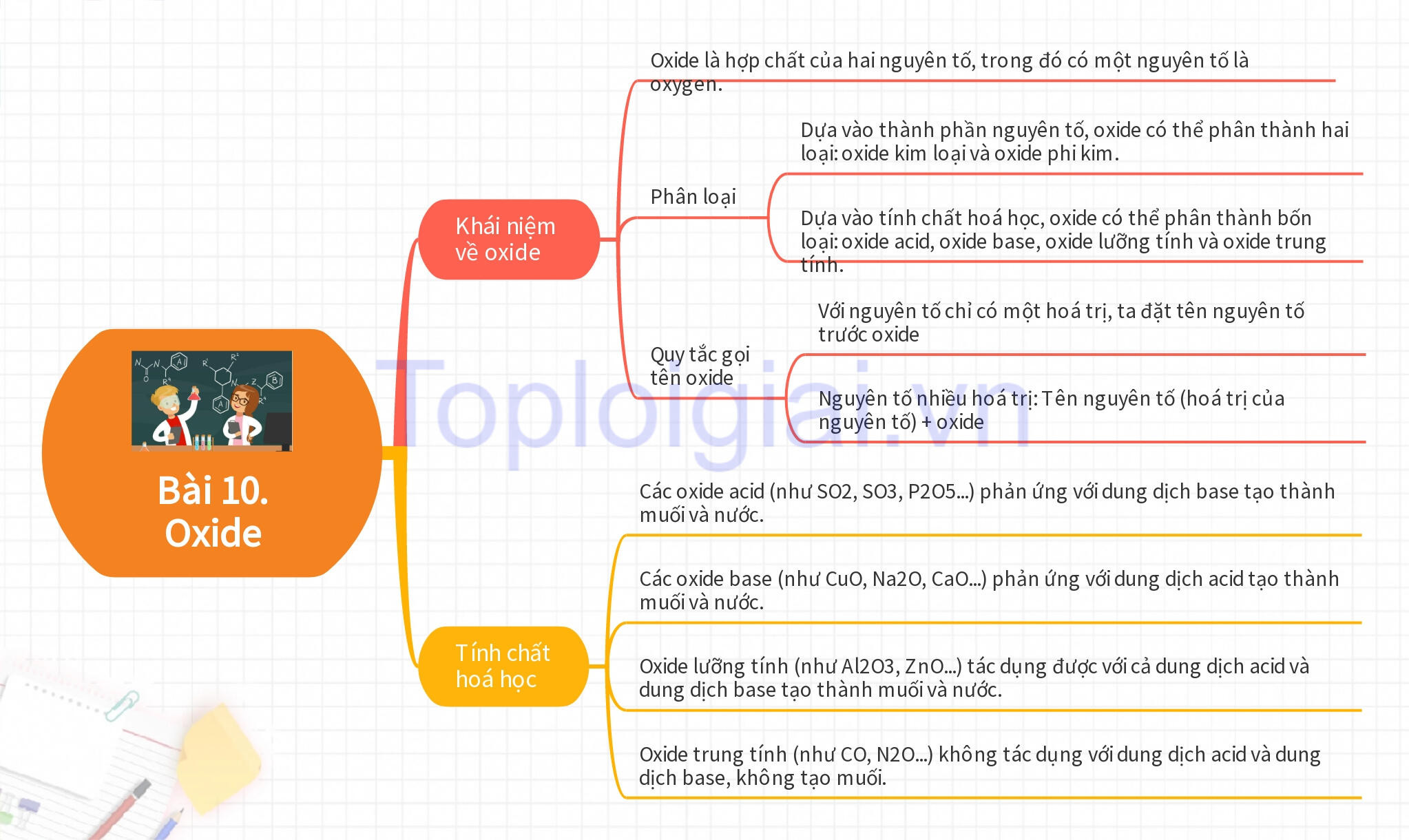
A. Lý thuyết KHTN 8 Bài 10: Oxide
I. Khái niệm về oxide
- Oxide là hợp chất của hai nguyên tố, trong đó có một nguyên tố là oxygen.
- Dựa vào thành phần nguyên tố, oxide có thể phân thành hai loại: oxide kim loại và oxide phi kim. Oxide kim loại được tạo thành từ phản ứng của kim loại với oxygen, ví dụ như phản ứng giữa Ba và O2 tạo ra BaO. Oxide phi kim được tạo thành từ phản ứng của phi kim với oxygen, ví dụ như phản ứng giữa C và O2 tạo ra CO2.
- Dựa vào tính chất hoá học, oxide có thể phân thành bốn loại: oxide acid, oxide base, oxide lưỡng tính và oxide trung tính.
- Quy tắc gọi tên oxide
+ Với nguyên tố chỉ có một hoá trị, ta đặt tên nguyên tố trước oxide, ví dụ như Sine oxide (ZnO).
+ Nguyên tố nhiều hoá trị: Tên nguyên tố (hoá trị của nguyên tố) + oxide
+ Cách đặt tên oxide của phi kim nhiều hoá trị:
+ (Tiền tố chỉ số nguyên tử của nguyên tố) Tên nguyên tố + (tiền tố chỉ số nguyên tử oxygen) oxide
+ (Tiền tố mono là một, đi là hai, trẻ là ba, tetra là bốn)
Ví dụ: FeO đọc là iron(II) oxide, CO đọc là carbon monoxide hoặc carbon(II) oxide, CO2 đọc là carbon dioxide hoặc carbon(IV) oxide
- Oxide acid tác dụng với dung dịch base tạo thành muối và nước.
Ví dụ: CO2 + Ca(OH)2 → CaCO3 + H2O
- Khi sục từ từ khí CO2 vào dung dịch Ca(OH)2, ban đầu dung dịch vẩn đục do tạo muối CaCO3 không tan.
- Các oxide acid (như SO2, SO3, P2O5...) phản ứng với dung dịch base tạo thành muối và nước.
Ví dụ: SO2 + Ca(OH)2 → CaSO3 + H2O.
- Để kiểm tra tính chất của oxide acid, ta có thể thực hiện thí nghiệm bằng cách cho bột đá vôi và dung dịch hydrochloric acid vào ống nghiệm, sau đó dẫn khí carbon dioxide vào để tạo thành khí carbonic, quan sát hiện tượng xảy ra.
- Các oxide base (như CuO, Na2O, CaO...) phản ứng với dung dịch acid tạo thành muối và nước.
Ví dụ: CuO + H2SO4 → CuSO4 + H2O.
- Để kiểm tra tính chất của oxide base, ta có thể thực hiện thí nghiệm bằng cách cho bột CuO và dung dịch H2SO4 vào ống nghiệm, sau đó quan sát hiện tượng xảy ra.
Oxide lưỡng tính:
Oxide lưỡng tính (như Al2O3, ZnO...) tác dụng được với cả dung dịch acid và dung dịch base tạo thành muối và nước. Ví dụ: Al2O3 + 6HCl → 2AlCl3 + 3H2O.
Oxide trung tính (như CO, N2O...) không tác dụng với dung dịch acid và dung dịch base, không tạo muối.
Sơ đồ tư duy KHTN 8 Bài 10: Oxide
B. Bài tập trắc nghiệm KHTN 8 Bài 10: Oxide
Câu 1. Chất nào sau đây là oxide base?
A. CO2.
B. BaO.
C. SO3.
D. Ba(OH)2.
Đáp án đúng là: B
BaO là oxide base.
Câu 2. Chất nào sau đây tác dụng được với dung dịch HCl?
A. Fe2O3.
B. NaCl.
C. CO2.
D. HNO3.
Đáp án đúng là: A
Fe2O3 là oxide base (basic oxide) nên tác dụng được với HCl.
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
Câu 3. Oxide lưỡng tính có đặc điểm là
A. tác dụng với dung dịch acid tạo thành muối và nước.
B. vừa tác dụng với dung dịch base và vừa tác dụng với dung dịch acid tạo thành muối và nước.
C. tác dụng với dung dịch base tạo thành muối và nước.
D. chỉ tác dụng được với muối.
Đáp án đúng là: B
Oxide lưỡng tính vừa tác dụng với dung dịch base, vừa tác dụng với dung dịch acid tạo thành muối và nước.
Câu 4. Chất nào sau đây là oxide lưỡng tính?
A. Fe2O3.
B. CaO.
C. SO3.
D. Al2O3.
Đáp án đúng là: D
Al2O3 là oxide lưỡng tính.
Câu 5. Trong các chất: KCl, CaO, HNO3, CO2, MgO, CuO, số lượng oxide là
A. 1. B. 2.
C. 3. D. 4.
Đáp án đúng là: D
Có 4 oxide trong dãy là: CaO; CO2; MgO; CuO.
Câu 6. Hợp chất X được tạo thành từ oxygen và một nguyên tố khác. Chất X thuộc loại chất nào sau đây?
A. Muối.
B. Acid.
C. Base.
D. Oxide.
Đáp án đúng là: D
X là oxide.
Câu 7. Oxide acid (acidic oxide) có đặc điểm là
A. tác dụng với dung dịch acid tạo thành muối và nước.
B. tác dụng với dung dịch base tạo thành muối và nước.
C. không tác dụng với dung dịch base và dung dịch acid.
D. chỉ tác dụng được với muối.
Đáp án đúng là: B
Oxide acid (acidic oxide) tác dụng với dung dịch base tạo thành muối và nước.
Câu 8. Tên gọi carbon dioxide ứng với công thức nào sau đây?
A. CO2.
B. CO.
C. C2O.
D. H2CO3.
Đáp án đúng là: A
Carbon dioxide: CO2.
Câu 9. Chất nào sau đây tác dụng được với dung dịch NaOH?
A. Na2O.
B. CaO.
C. SO2.
D. Fe2O3.
Đáp án đúng là: C
SO2 là oxide acid (acidic oxide) nên tác dụng được với dung dịch NaOH.
SO2 + 2NaOH → Na2SO3 + H2O.
Câu 10. Oxide base (basic oxide) có đặc điểm là
A. tác dụng với dung dịch acid tạo thành muối và nước.
B. tác dụng với dung dịch base tạo thành muối và nước.
C. không tác dụng với dung dịch base và dung dịch acid.
D. chỉ tác dụng được với muối.
Đáp án đúng là: A
Oxide base (basic oxide) tác dụng với dung dịch acid tạo thành muối và nước.
Câu 11. Trong các oxide: CaO, HCl, FeO, CO, CO2, MgO, Na2O, số lượng basic oxide/oxide base là
A. 3. B. 4.
C. 5. D. 6.
Đáp án đúng là: B
Các basic oxide/oxide base là: CaO; FeO; MgO; Na2O.
Câu 12. SO2 là
A. oxide acid.
B. oxide base.
C. oxide trung tính.
D. oxide lưỡng tính.
Đáp án đúng là: A
SO2 là oxide acid (acidic oxide).
Câu 13. Dãy các chất đều là oxide base?
A. CuO, CO2, CaO. Na2O.
B. CO2, SO2, P2O5, N2O5.
C. CuO, MgO, K2O, CaO.
D. CO2, CaO, FeO, CuO.
Đáp án đúng là: C
Dãy các chất đều là oxide base: CuO, MgO, K2O, CaO.
Câu 14. Một nguyên tố R có hoá trị II. Trong thành phần oxide của R, oxygen chiếm 40% về khối lượng. Công thức oxide đó là
A. CuO.
B. SO2.
C. MgO.
D. Al2O3.
Đáp án đúng là: C
R hoá trị II nên oxide có công thức RO.
Tỉ lệ oxygen:
Vậy R là Mg, oxide là MgO.
Câu 15. “Nước đá khô” không nóng chảy mà dễ thăng hoa nên được dùng để tạo môi trường lạnh và khô, rất tiện cho việc bảo quản thực phẩm. “Nước đá khô” là
A. CO rắn.
B. SO2 rắn.
C. CO2 rắn.
D. H2O rắn.
Đáp án đúng là: C
Nước đá khô là CO2 ở trạng thái rắn.