Tailieumoi.vn xin giới thiệu phương trình N2 + O2 2NO gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nito. Mời các bạn đón xem:
Phương trình N2 + O2 2NO
1. Phương trình phản ứng hóa học
N2 + O2 2NO
2. Hiện tượng nhận biết phản ứng
Không có dấu hiệu nhận biết đặc biệt.
3. Điều kiện phản ứng
Nhiệt độ khoảng 3000oC hoặc nhiệt độ của lò hồ quang điện.
4. Tính chất hoá học
- Ở điều kiện thường, nitơ kém hoạt động hóa học vì có liên kết ba bền. Ở nhiệt độ cao, liên kết ba đẽ đứt hơn nên nitơ hd hóa học hơn.
- Nitơ vừa có tính oxi hóa, vừa có tính khử
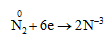
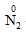
Tính oxi hóa
a. Tác dụng với hiđro
b. Tác dụng với kim loại hoạt động
- Nitơ oxi hóa liti (Li) ở nhiệt độ thường:
- Nitơ chỉ oxi hóa các kim loại hoạt động khi đốt nóng:
Tính khử
5. Cách thực hiện phản ứng
Ở nhiệt độ khoảng 3000oC nitơ kết hợp trực tiếp với oxi.
6. Bạn có biết
Ở điều kiện thường khí NO không màu sẽ kết hợp ngay với oxi không khí tạo ra khí nitơ đioxit có màu nâu đỏ.
2NO + O2 → 2NO2
7. Bài tập liên quan
Ví dụ 1: Nitơ thể hiện tính khử trong phản ứng với chất nào sau đây?
A. H2
B. O2
C. Ca
D. Mg
Hướng dẫn giải
Đáp án đúng là: B
N2 + O2 2NO
Do N có số oxi hóa tăng từ 0 lên +2
Ví dụ 2: Ứng dụng nào sau đây không phải của nitơ?
A. Làm môi trường trơ trong một số ngành công nghiệp.
B. Bảo quản máu và các mẫu vật sinh học.
C. Tổng hợp ra khí NH3 từ đó sản xuất ra axit nitric.
D. Sản xuất phân lân.
Hướng dẫn giải
Đáp án đúng là: D
Một số ứng dụng của nitơ: Tổng hợp amoniac, làm môi trường trơ, nitơ lỏng được dùng để bảo quản máu và các mẫu vật sinh học khác.
Ví dụ 3: Khi có tia lửa điện hoặc ở nhiệt độ cao, nitơ tác dụng trực tiếp với oxi tạo ra hợp chất A. A là
A. N2O
B. NO2
C. NO
D. N2O5
Hướng dẫn giải
Đáp án đúng là: C
N2 + O2 2NO
8. Một số phương trình phản ứng hoá học khác của Nito và hợp chất:
2NH4NO3 + Ba(OH)2 → Ba(NO3)2 + 2NH3↑ + 2H2O
NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O