Tailieumoi.vn xin giới thiệu phương trình N2 + 3H2 ⇄ 2NH3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nito. Mời các bạn đón xem:
Phương trình N2 + 3H2 ⇄ 2NH3
1. Phương trình phản ứng hóa học
N2 + 3H2 ⇄ 2NH3
2. Hiện tượng nhận biết phản ứng
Có khí mùi khai thoát ra.
3. Điều kiện phản ứng
- Nhiệt độ khoảng 450 – 500oC.
- Áp suất khoảng 200 – 300 atm.
- Chất xúc tác: Sắt kim loại được trộn thêm Al2O3, K2O, …
4. Tính chất hoá học
- Ở điều kiện thường, nitơ kém hoạt động hóa học vì có liên kết ba bền. Ở nhiệt độ cao, liên kết ba đẽ đứt hơn nên nitơ hd hóa học hơn.
- Nitơ vừa có tính oxi hóa, vừa có tính khử
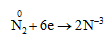
Tính oxi hóa
a. Tác dụng với hiđro
b. Tác dụng với kim loại hoạt động
- Nitơ oxi hóa liti (Li) ở nhiệt độ thường:
- Nitơ chỉ oxi hóa các kim loại hoạt động khi đốt nóng:
Tính khử
5. Cách thực hiện phản ứng
Cho N2 tác dụng với H2 ở nhiệt độ cao, áp suất cao, có mặt chất xúc tác Fe.
Hình 1. Sơ đồ thiết bị tổng hợp amoniac trong công nghiệp
6. Bạn có biết
- Đặc điểm của phản ứng này là tốc độ rất chậm ở nhiệt độ thường, tỏa nhiệt và số mol khí của sản phẩm ít hơn so với số mol khí của các chất phản ứng. Do đó người ta phải thực hiện phản ứng này ở nhiệt độ cao, áp suất cao và có mặt của chất xúc tác. Ở áp xuất cao, cân bằng chuyển dịch sang phía tạo ra NH3, nhưng ở nhiệt độ cao cân bằng chuyển dịch ngược lại, nên chúng ta cần phải chọn 1 nhiệt độ cao vừa phải để hiệu suất tạo ra NH3 cao.
- Hiệu suất chuyển hóa thành NH3 chỉ đạt tới 20 – 25%.
7. Bài tập liên quan
Ví dụ 1: Nitơ thể hiện tính oxi hóa trong phản ứng với các chất nào dưới đây?
A. H2, O2
B. O2, Mg
C. Mg, H2
D. Ca, O2
Hướng dẫn giải
Đáp án đúng là: C
N2 thể hiện tính oxi hóa khi tác dụng với H2 và một số kim loại.
3Mg + N2 Mg3N2
N2 + 3H2 2NH3
Ví dụ 2: Khí NH3 có lẫn hơi nước. Hóa chất dùng để làm khô khí NH3 là
A. P2O5
B. H2SO4 đặc
C. CaO
D. Cả A, B, C đều đúng
Hướng dẫn giải
Đáp án đúng là: C
Chất để làm khô khí NH3 là chất mà không tác dụng với NH3 và có khả năng hút ẩm.
Ví dụ 3: Hỗn hợp N2 và H2 có tỉ khối hơi so với H2 là 6,2. Sau khi tổng hợp thu được hỗn hợp có tỉ khối hơi so với H2 là 6,74. Hiệu suất của phản ứng là:
A. 10%.
B. 15%.
C. 10,8%.
D. 20%.
Hướng dẫn giải
Đáp án đúng là: D
N2 + 3H2 ⇄ 2NH3
Ta có:
⇒ Hiệu suất tính theo H2.
Giả sử:
Bảo toàn khối lượng ta có: mban đầu = mSau phản ứng
⇒ nban đầu .6,2.2 = nsau phản ứng.6,74.2
⇒ nsau phản ứng = mol
8. Một số phương trình phản ứng hoá học khác của Nito và hợp chất:
2NH4NO3 + Ba(OH)2 → Ba(NO3)2 + 2NH3↑ + 2H2O
NH4NO3 + NaOH → NaNO3 + NH3↑ + H2O