Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Bài tập về ôn tập học kì 2 hóa học 10 có chọn lọc môn Hóa học lớp 10, tài liệu bao gồm 59 trang, đầy đủ lý thuyết, phương pháp giải chi tiết và bài tập có đáp án (có lời giải), giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi môn Hóa học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
CHƯƠNG 5 : NHÓM HALOGEN
A. TÓM TẮT CÁC PHƯƠNG TRÌNH HÓA HỌC TRONG SGK CƠ BẢN VÀ NÂNG CAO
1.
2. H2 + Cl2 → 2HCl↑ (khí hidro clorua)
3. Cl2 + H2O HClO + HCl
(HClO: axit hipoclorơ)
4. Cl2 + 2NaOH → NaCl + NaClO + H2O
(nước Javen)
5. 3Cl2 + 6KOH → KClO3 + 5KCl + 3H2O
(KClO3: kali clorat)
6. Cl2 + Ca(OH)2 → CaOCl2 + H2O
( clorua vôi)
7. Cl2 + 2NaBr → 2NaCl + Br2
8. Cl2 + 2NaI → 2NaCl + I2
9. Cl2+ SO2 + 2H2O → 2HCl + H2SO4
10. Cl2 + 2FeCl2 →2FeCl3
11. MnO2 + 4HCl đ → 2MnCl2 + Cl2↑ + 2H2O
12. 2KMnO4 + 16HCl đ → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
13. 2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
14. K2Cr2O7 + 14HCl đ → 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
15. KClO3 + 6HCl đ → KCl + 3Cl2↑ + 3H2O
16. NaCl rắn + H2SO4 đặc → NaHSO4 + HCl↑
17. 2NaCl rắn + H2SO4 đặc→ Na2SO4 + 2HCl↑
18. 2HCl + Fe → FeCl2 + H2↑
19. 6HCl + Fe2O3 → 2FeCl3 + 3H2O
20. 8HCl + Fe3O4 → FeCl2 + 2FeCl3 + 4H2O
21. NaClO + CO2 + H2O → NaHCO3 + HClO
22. CaOCl2+ CO2 + H2O→CaCO3 + CaCl2 + 2HClO
23. CaOCl2 + 2HCl → CaCl2 + Cl2+ H2O
24. 2KClO3 →2KCl + 3O2↑
25. H2 + Br2 →2HBr↑
26. Br2 + 2NaI → 2NaBr + I2
27. 2Al + 3I2 → 2AlI3
28. 3Br2 + 2Fe →2FeBr3
29. H2 + I2 →2HI
30. H2 + F2 →2HF↑
31. 2F2 + 2H2O → 4HF + O2↑
32. 3F2 + Au → 2AuF3
33. 3F2 + S → SF6
34. CaF2 + H2SO4 → 2HF + CaSO4
35. 2AgCl →2Ag + Cl2
36. 2AgBr →2Ag + Br2
37. 4HF + SiO2 → SiF4 + 2H2O (phản ứng ăn mòn thủy tinh)
B. BÀI TẬP TỰ LUẬN
· Dạng 1: Viết phương trình chứng minh
Bài 1: Viết phương trình chứng minh:
a) Clo có tính oxi hóa.:
b) Clo có tính khử
c) Clo vừa có tính oxi hóa vừa có tính khử.
d) Axit clohiđric có tính khử.
e) Axit clohiđric có tính oxi hoá.
f) Axit clohiđric là axit mạnh.
g) Flo có tính oxi hóa
h) Brom có tính oxi hóa
i) Iot có tính oxi hóa
j) Flo có tính oxi hoá mạnh hơn clo, brom, iot.
k) Clo có tính oxi hoá mạnh hơn brom, iot.
l) Brom có tính oxi hoá mạnh hơn iot nhưng yếu hơn clo.
.................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
· Dạng 2: Giải thích và viết phương trình chứng minh
Bài 2: Giải thích hiện tượng và viết phương trình phản ứng (nếu có) khi:
a) Nhúng quỳ tím vào dd axit clohiđric.
b) Cho quỳ tím ẩm tiếp xúc với khí hiđro clorua.
c) Nhúng quỳ tím vào nước clo.
d) Cho dd muối bạc nitrat vào dd muối natri clorua, natri bromua, natri iotua.
e) Để hở bình đựng dd HBr trong không khí?
f) Cho iot tiếp xúc với hồ tinh bột.
g) Sục từ từ khí clo vào dd hồ tinh bột có hoà tan sẵn một lượng nhỏ KI, thấy xuất hiện màu xanh tím.
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
Bài 3: Hãy giải thích tại sao:
a) Trong các hợp chất, flo luôn có số oxi hoá âm còn các halogen khác ngoài số oxi hoá âm còn có số oxi hoá dương?
b) Trong phòng thí nghiệm không đựng dd axit HF vào bình thuỷ tinh?
c) Nước Javen có khả năng tẩy trắng vải, sợi, giấy, tẩy uế chuồng trại chăn nuôi, nhà vệ sinh,…
d) Nước Javen để lâu trong không khí thì mất dần tính tẩy màu.
e) Trên thực tế người ta dùng clorua vôi nhiều hơn nước Javen.
f) Phải nêm muối ăn sau khi thực phẩm được nấu chin và còn hơi nóng?
g) Các phản ứng điều chế clo bằng cách dùng các chất oxi hoá mạnh MnO2, KMnO4, KClO3, … tác dụng với dd axit HCl lại không áp dụng trong công nghiệp?
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
· Dạng 3: Nhận biết
Bài 4: Nhận biết các dung dịch sau:
a) NaOH, HCl, NaNO3, NaCl, Na2S.
b) KOH, KCl, KNO3, K2SO4, Na2CO3.
c) NaOH, KCl, NaNO3, K2SO4, K2SO3.
d) NaCl, K2SO4, Na2CO3, Na2S, HNO3.
e) NaCl, NaOH, HCl, Na2CO3, NaI, Ba(NO3)2.
f) KCl, HCl, K2SO4, K2S.
g) NaOH, HCl, CuSO4, KI, Ba(NO3)2.
Bài 5: Chỉ dùng 1 thuốc thử, hãy nhận biết các dd sau:
a) KI, NaCl, HNO3
b) KBr, ZnI2, HCl, Mg(NO3)2
c) CaI2, AgNO3, Hg(NO3)2, HI
d) KI, NaCl, Mg(NO3)2, HgCl2
e) HCl, NaCl, NaOH, CuSO4
f) NaF, NaCl, NaBr, NaI
· Dạng 4: Thực hiện chuỗi phản ứng , bổ túc phương trình phản ứng
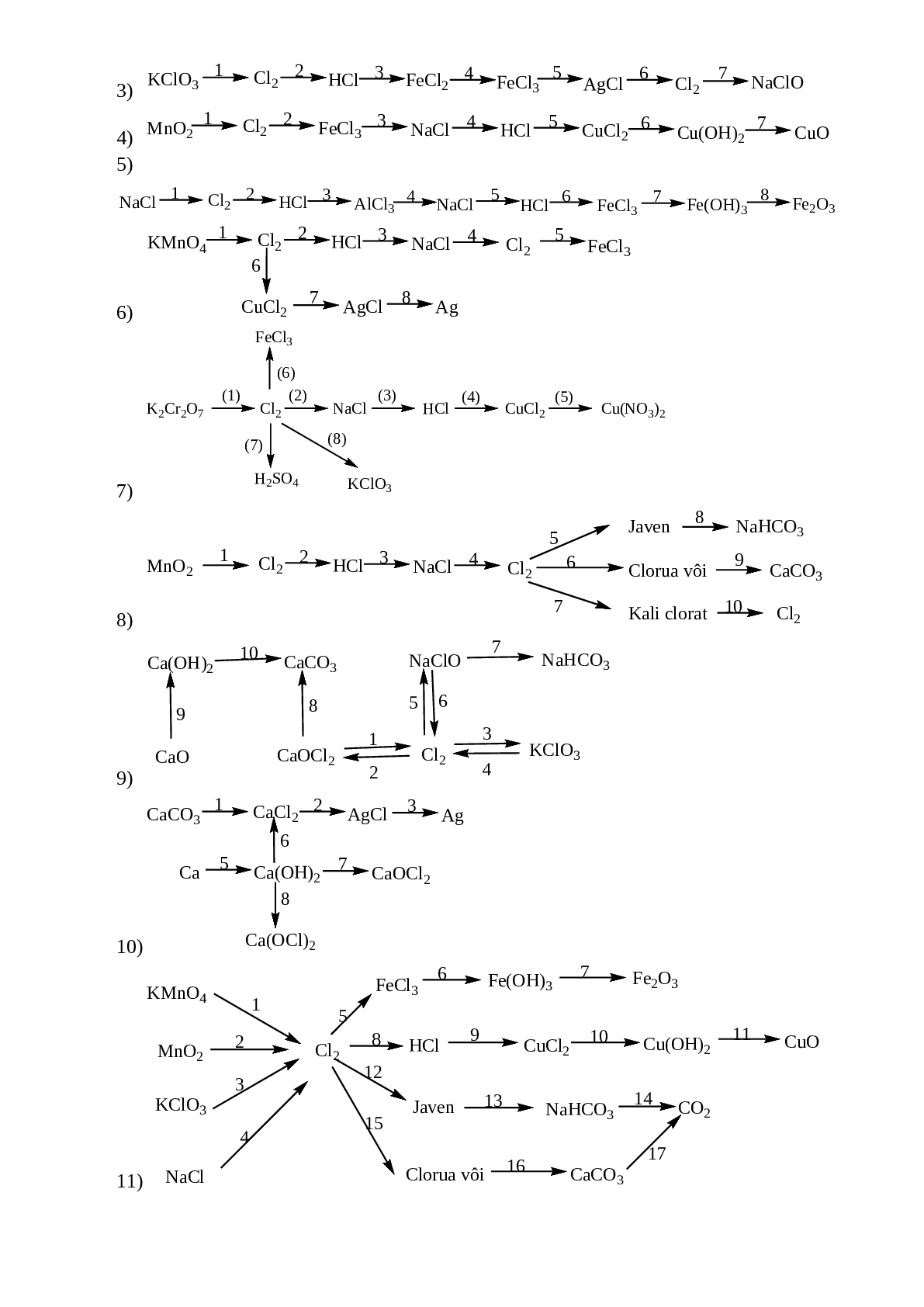
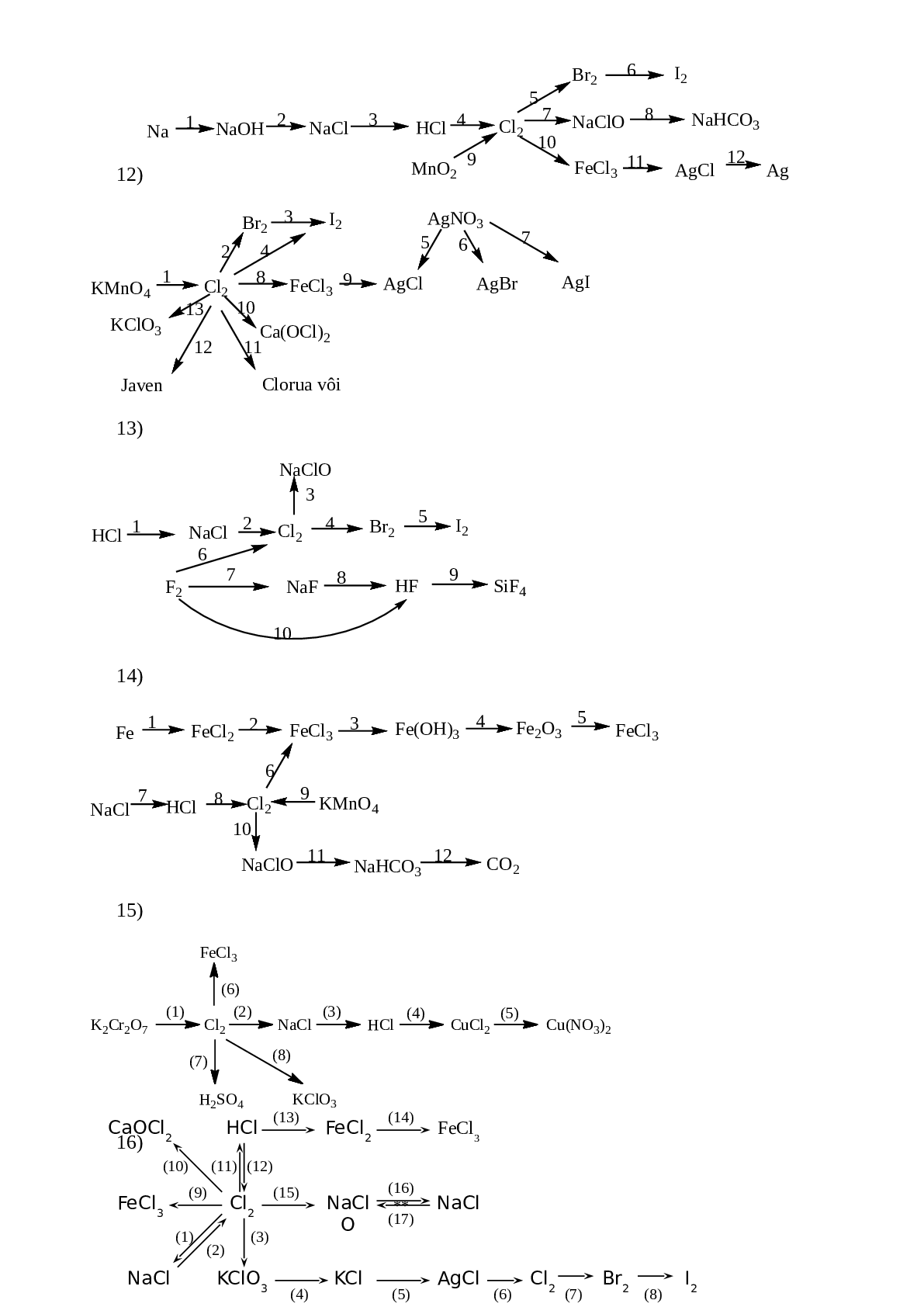
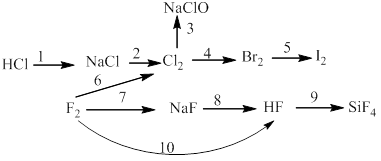
Bài 6: Thực hiễn chuối phản ứng sau:
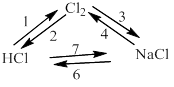
1) 
2) ![]()
3) ![]()
4) ![]()
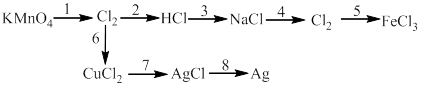
5) 
6) 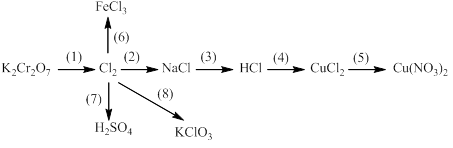
7) 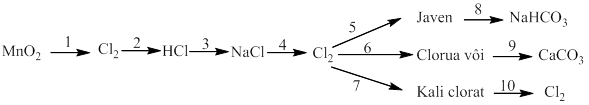
8) 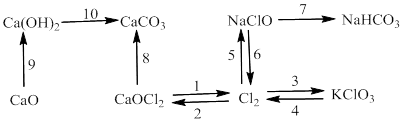
9) 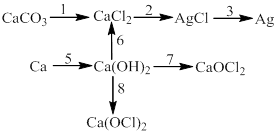
10) 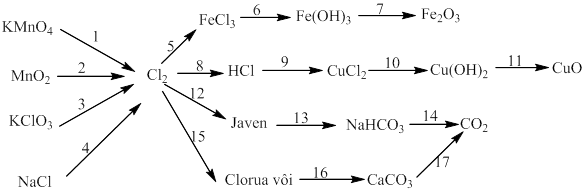
11) 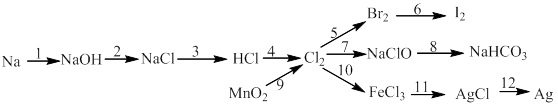
12) 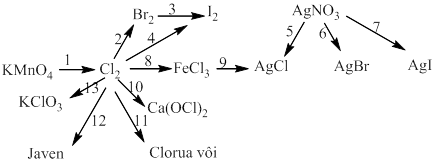
13) 
14) 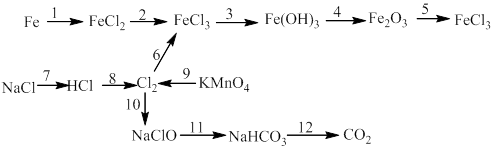
15) 
16)
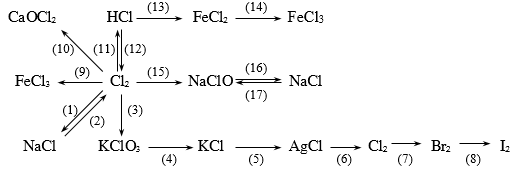
17)
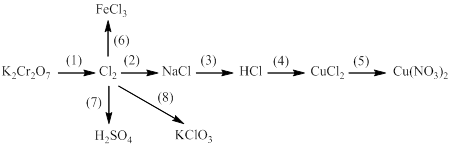
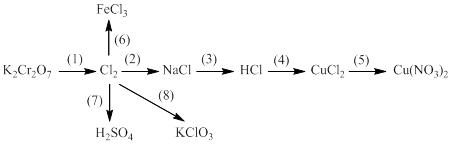
Bài 7: Bổ túc các phương trình phản ứng
1. ? + HCl → ? + Cl2 + ?
2. ? + ? → ? + CuCl2
3. ? + HCl → ? + CO2 + ?
4. Cl2 + ? + ? → H2SO4 + ?
5. ? + NaOH → NaClO + ?
6. Cl2+ ..... → KClO3 + ..... + .....
7. HCl + ..... → ..... + ..... + Cl2
8. Cl2 + ..... → NaClO + .....
9. KMnO4 + .......→ ..... + Cl2 + .....+.....
10. Cl2 + ..... → KClO + .....+....
11. Cl2 + ? →HCl
12. NaI + ? → NaBr + ?
13. Cl2 + ? → nuớc javen
14. Fe(OH)2 + HCl → ? + ?
15. MnO2 + ? → Cl2 + ? + ?
16. Br2 + ? → HBrO + ?
17. Cl2 + Fe →........
18. K2Cr2O7 + ? → KCl + ..... + .....+ …..
19. NaCl + ….. → khí A + khí B + NaOH
20. ? + ? →CuCl2 + ?
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
· Dạng 5: Tính toán theo phương trình phản ứng
Câu 1. Cho 3,2 gam đồng (Cu) tác dụng với một lượng khí Cl2 vừa đủ.
a) Tính thể tích khí clo (Cl2) (đktc) tham gia phản ứng.
b) Tính khối lượng muối đồng thu được sau phản ứng.
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
Câu 2. Tính khối lượng natri (Na) và thể tích khí clo (Cl2) cần để điều chế 4,68g muối NaCl.
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
Câu 3. Xác định khối lượng thuốc tím KMnO4 và HCl cần dùng để điều chế 5,6 lít khí clo (Cl2) ở đktc.
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
Câu 4. Để trung hoà 200 ml dung dịch NaOH 1,5 M thì thể tích dung dịch HCl 0,5 M cần dùng là bao nhiêu?
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
Câu 5. Cho bột nhôm dư vào 200 ml dung dịch axit HCl 1M ta thu được khí H2 bay ra.Viết phương trình phản ứng và tính thể tích khí H2 thoát ra ở đktc.
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
Câu 6. Cho 50g dd HCl tác dụng dd NaHCO3 dư thu được 2,24lit khí ở đktc. Tìm nồng độ phần trăm của dd HCl đã dùng?
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
Câu 7. Cho 8,4 gam sắt tác dụng với một lượng dung dịch HCl vừa đủ. Dẫn toàn bộ lượng khí sinh ra qua 16 gam đồng (II) oxit nóng.
a) Tính thể tích khí hiđro sinh ra (đktc)
b) Tính khối lượng kim loại đồng thu được sau phản ứng.
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
Câu 8. Cho a (g) Fe tác dụng vừa đủ 150ml dung dịch HCl (D = 1,2 g/ml) thu được dung dịch và 6,72 lít khí (đktc). Cho toàn bộ lượng dung dịch trên tác dụng với dung dịch AgNO3 dư, thu được b (g) kết tủa.
a) Viết các phương trình phản ứng.
b) Tìm giá trị a, b?
c) Tính nồng độ phần trăm và nồng độ mol/l dung dịch HCl?
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
· Dạng 6 : Toán về lượng dư
Câu 1. Cho 4,8 gam Mg vào dung dịch HCl sau phản ứng thu được 2,24 lít H2 (đktc). Tính lượng Mg còn dư và khối lượng muối thu được sau phản ứng.
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................
..................................................................................................................................................................