Tailieumoi.vn xin giới thiệu đến các quý thầy cô Giáo án Hóa học 10 chuyên đề: Các đơn chất của halogen mới nhất theo mẫu Giáo án môn Hóa học chuẩn của Bộ Giáo dục. Hi vọng tài liệu này sẽ giúp thầy/cô dễ dàng biên soạn chi tiết Giáo án môn Hóa học lớp 10. Chúng tôi rất mong sẽ được thầy/cô đón nhận và đóng góp những ý kiến quý báu của mình.
Mời các quý thầy cô cùng tham khảo và tải về chi tiết tài liệu dưới đây:
Tiết 39-42: Các đơn chất halogen.
I. Mục tiêu
1. Kiến thức
- Học sinh trình bày được trạng thái tự nhiên của flo, clo, brom, iot.
- Học sinh nêu được một số tính chất vật lý, ứng dụng và phương pháp điều chế flo, clo, brom, iot trong phòng thí nghiệm và trong công nghiêp.
- Học sinh nêu được tính chất hóa học cơ bản của các halogen là tính oxy hóa mạnh: oxy hóa kim loại, phi kim và một số hợp chất.
- Học sinh giải thích được tính chất hóa học đặc trưng của các đơn chất halogen là tính oxy hóa mạnh, giải thích được quy luật biến đổi tính oxi hóa (từ flo đến iot tính oxy hóa giảm dần).
- Học sinh nêu được trong một số phản ứng clo, brom, iot còn thể hiện tính khử.
2. Kĩ năng
- Khai thác mối liên hệ giữa vị trí và tính chất hóa học của các đơn chất halogen.
- Viết phương trình hóa học minh họa cho tính oxy hóa mạnh và tình khử của halogen, viết phương trình điều chế khí clo trong PTN và trong công nghiêp.
- Quan sát thí nghiệm, hình ảnh...rút ra được nhận xét về tính chất.
- Làm bài tập tổng hợp.
- Học sinh rèn luyện nâng cao kĩ năng làm việc nhóm hiệu quả.
3. Thái độ:
- Say mê, hứng thú, tự chủ trong học tập; trung thực; yêu khoa học.
- Giáo dục đức tính cẩn thận chính xác khi sử dụng hóa chất, tiến hành thí nghiệm.
- Nâng cao ý thức bảo vệ môi trường.
4. Năng lực
- Năng lực vận dụng kiến thức hoá học vào cuộc sống.
- Năng lực sử dụng ngôn ngữ hoá học.
- Qua việc thực hiện các hoạt động học trong bài học, học sinh được rèn luyện về năng lực tự học, năng lực hợp tác, làm việc nhóm, phát hiện và giải quyết vấn đề.
II. Phương pháp và kĩ thuật
- Phương pháp hợp tác
- Phương pháp đoàn thoại.
- Sử dụng phiếu học tập.
III. Chuẩn bị.
1. Giáo viên:
- giáo án điện tử, bảng nhóm.
- phiếu học tập.
2. Học sinh:
Chuẩn bị trước nội dung bài học.
IV. Tiến trình dạy học.
1. Hoạt động khởi động:
a) Mục tiêu: gây hứng thú, kích thích sự tò mò để hướng học sinh tham gia kiến thức mới
b) Phương pháp : đàm thoại gợi mở
c) Cách thức thực hiện: Tổ chức trò chơi “Đố bạn biết mình là ai?”
d) Tiến trình thức hiện:
|
Hoạt động của giáo viên |
Hoạt động của học sinh |
Nội dung |
|
- GV đưa ra các câu hỏi và HS có 30s để đưa ra câu trả lời của mình bằng cách giơ tay trả lời. 1. Mình là chất lỏng màu đỏ nâu. Bạn nên cẩn thận khi tiếp xúc với mình. Mình rất độc đấy! 2. Nhờ có mình mà các bạn có chảo không dính để chiên trứng và nếu không có mình chắc các bạn sẽ bị sâu răng đấy! 3. Mình không bị bệnh gan đâu, chẳng hiểu sao da mình cứ có màu vàng lục. 4. Nếu tìm được mình, bạn sẽ thấy mình ở dạng rắn (ở đk thường) có màu đen tím. Trong hợp chất muối mình chống bệnh bướu cổ cho bạn đấy!
|
HS lắng nghe và trả lời các câu hỏi của giáo viên.
|
Đáp án của câu hỏi: 1. Brom 2. Flo 3. Clo 4. Iot |
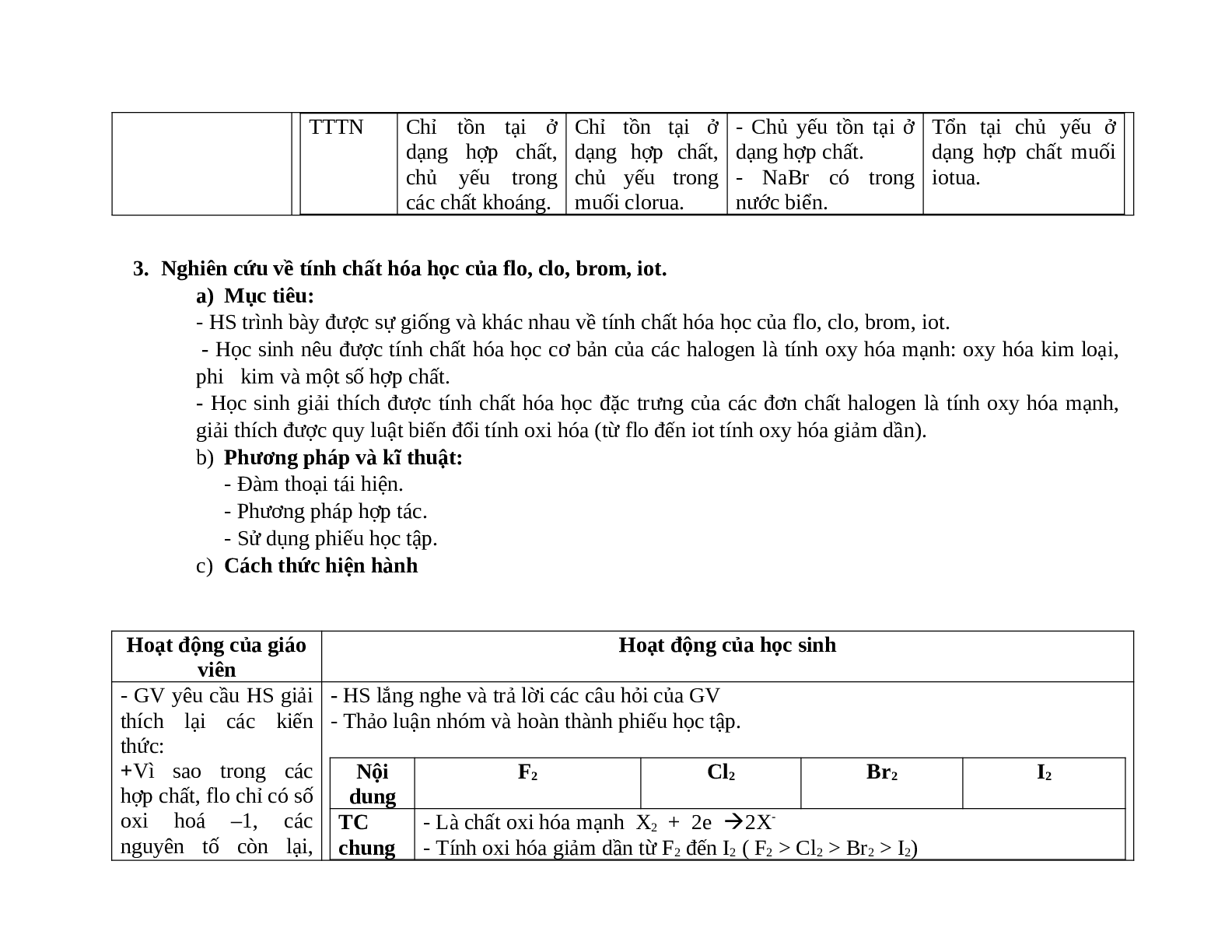
2. Nghiên cứu về tính chất vật lý và trạng thái tự nhiên của flo, clo, brom, iot.
a) Mục tiêu:
- HS trình bày được tính chất vật lý của các đơn chất halogen. Các halogen là các chất độc hại.
- HS nêu được trạng thái tự nhiên của các halogen.
b) Phương pháp và kĩ thuật
- Dạy học hợp tác.
- Sử dụng phiếu học tập.
c) Tiến trình thực hiện
|
Hoạt động của giáo viên |
Hoạt động của học sinh |
|||||||||||||||
|
- Gv gọi HS nhắc lại về tcvl của các đơn chất halogen. - GV yêu cầu HS thảo luận nhóm đôi tìm hiểu về trạng thái tự nhiên của các đơn chất halogen. - GV nhận xét và rút ra kết luận. |
- HS tìm hiểu kiến thức trong sgk và trả lời câu hỏi của GV - HS thảo luận nhóm đôi và trả lời câu hỏi. - HS ghi chép lại nội dung bài học.
|
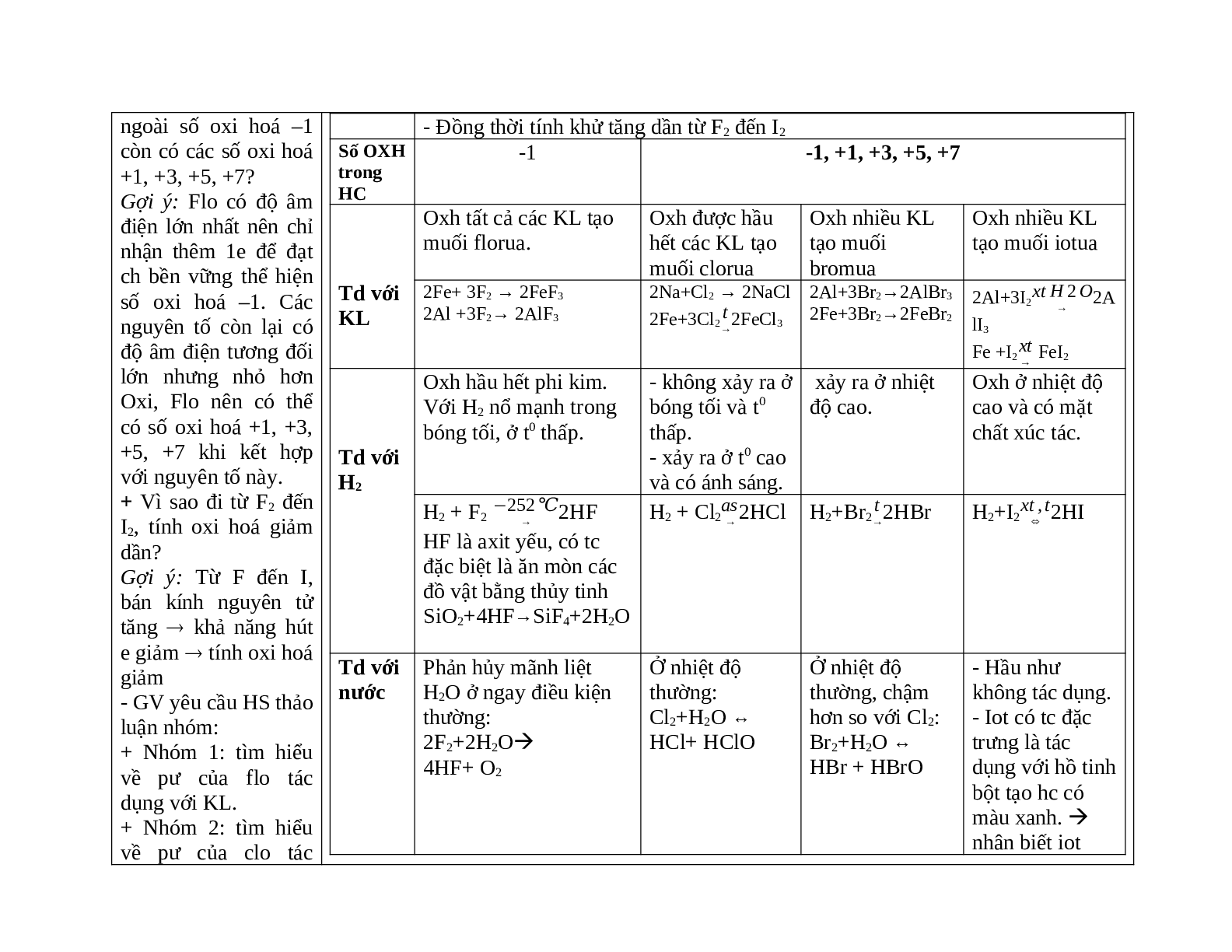
3. Nghiên cứu về tính chất hóa học của flo, clo, brom, iot.
a) Mục tiêu:
- HS trình bày được sự giống và khác nhau về tính chất hóa học của flo, clo, brom, iot.
- Học sinh nêu được tính chất hóa học cơ bản của các halogen là tính oxy hóa mạnh: oxy hóa kim loại, phi kim và một số hợp chất.
- Học sinh giải thích được tính chất hóa học đặc trưng của các đơn chất halogen là tính oxy hóa mạnh, giải thích được quy luật biến đổi tính oxi hóa (từ flo đến iot tính oxy hóa giảm dần).
b) Phương pháp và kĩ thuật:
- Đàm thoại tái hiện.
- Phương pháp hợp tác.
- Sử dụng phiếu học tập.
c) Cách thức hiện hành
|
Hoạt động của giáo viên |
Hoạt động của học sinh |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
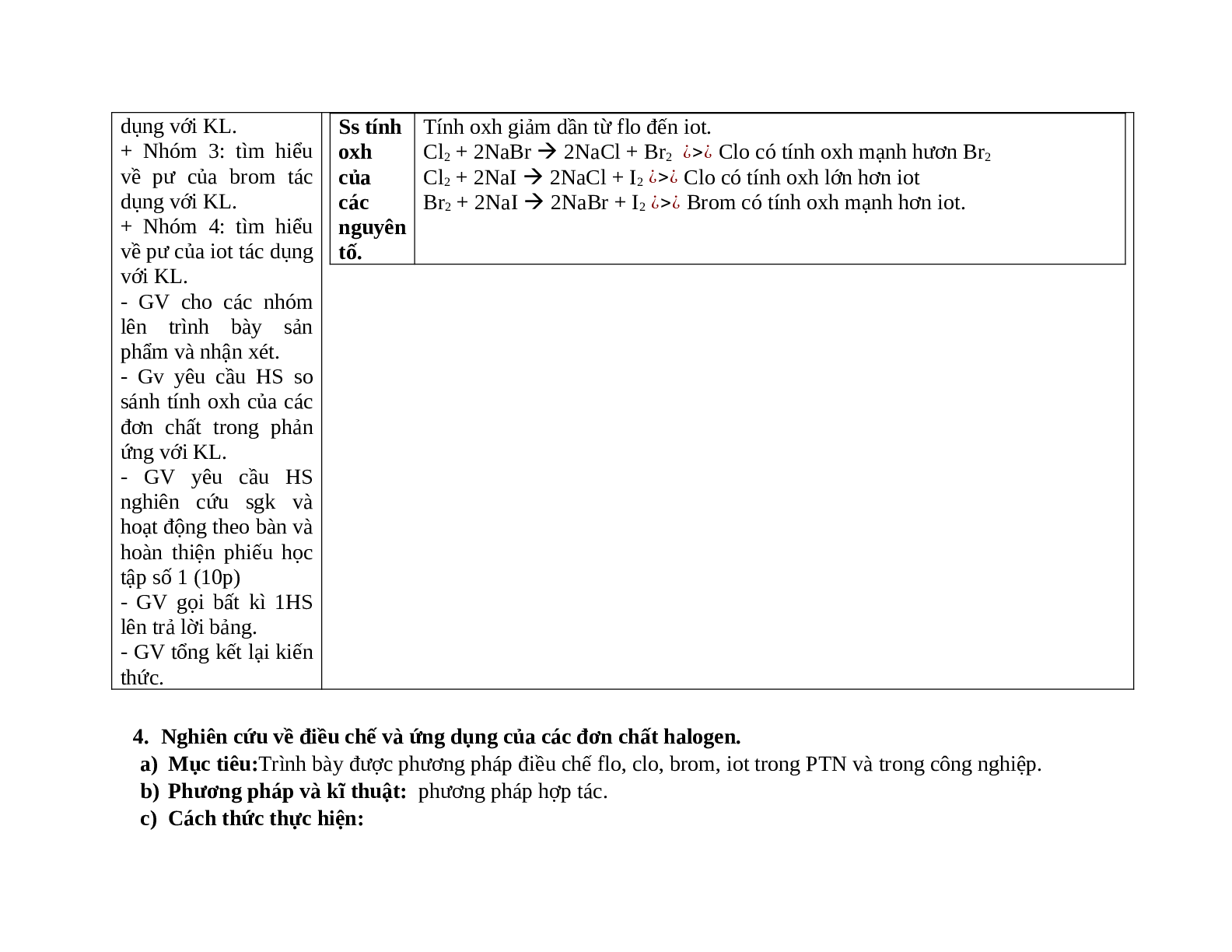
- GV yêu cầu HS giải thích lại các kiến thức: +Vì sao trong các hợp chất, flo chỉ có số oxi hoá –1, các nguyên tố còn lại, ngoài số oxi hoá –1 còn có các số oxi hoá +1, +3, +5, +7? Gợi ý: Flo có độ âm điện lớn nhất nên chỉ nhận thêm 1e để đạt ch bền vững thể hiện số oxi hoá –1. Các nguyên tố còn lại có độ âm điện tương đối lớn nhưng nhỏ hơn Oxi, Flo nên có thể có số oxi hoá +1, +3, +5, +7 khi kết hợp với nguyên tố này. + Vì sao đi từ F2 đến I2, tính oxi hoá giảm dần? Gợi ý: Từ F đến I, bán kính nguyên tử tăng ® khả năng hút e giảm tính oxi hoá giảm - GV yêu cầu HS thảo luận nhóm: + Nhóm 1: tìm hiểu về pư của flo tác dụng với KL. + Nhóm 2: tìm hiểu về pư của clo tác dụng với KL. + Nhóm 3: tìm hiểu về pư của brom tác dụng với KL. + Nhóm 4: tìm hiểu về pư của iot tác dụng với KL. - GV cho các nhóm lên trình bày sản phẩm và nhận xét. - Gv yêu cầu HS so sánh tính oxh của các đơn chất trong phản ứng với KL. - GV yêu cầu HS nghiên cứu sgk và hoạt động theo bàn và hoàn thiện phiếu học tập số 1 (10p) - GV gọi bất kì 1HS lên trả lời bảng. - GV tổng kết lại kiến thức. |
- HS lắng nghe và trả lời các câu hỏi của GV - Thảo luận nhóm và hoàn thành phiếu học tập.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
4. Nghiên cứu về điều chế và ứng dụng của các đơn chất halogen.
a) Mục tiêu:Trình bày được phương pháp điều chế flo, clo, brom, iot trong PTN và trong công nghiệp.
b) Phương pháp và kĩ thuật: phương pháp hợp tác.
c) Cách thức thực hiện:
|
Hoạt động của GV |
Hoạt động của HS |
|
- GV chia lớp thành 4 nhóm, yêu cầu HS thảo luận: + Nhóm 1: phương pháp điều chế khí flo. + Nhóm 2: phương pháp điều chế khí clo. + Nhóm 3: phương pháp điều chế khí brom. + Nhóm 4: phương pháp điều chế khí iot. - GV quan sát và giúp đỡ các nhóm thảo luận. - GV nhận xét và tổng kết lại kiến thức cho HS. - GV yêu cầu HS về nhà tự tìm hiểu ứng dụng của các đơn chất halogen. |
- Các nhóm nghiên cứu nội dung thảo luận của nhóm mình và trình bày ra bảng nhóm. 1. Điều chế flo. Phương pháp duy nhất có thể điều chế flo là điện phân hỗn hợp KF và HF (hỗn hợp ở thể lỏng). 2. Điều chế clo. a,Trong PTN: Cho axit HClđặc tác dụng với các chất OXH mạnh ( KMnO4, MnO2, PbO2, KClO3,..) 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O 16HCl + 2KMnO4 → 2MnCl2 + 2KCl + 5Cl2 + 8H2O b.Trong công nghiệp: điện phân dung dịch muối NaCl bão hòa trong nước.
2NaCl + 2H2O → 2NaOH + Cl2 + H2 Anot Catot 3. Điều chế brom. Dùng Cl2 để oxh NaBr (có trong nước biển) thành Br2. Cl2 + 2NaBr→ 2NaCl + Br2 4.Điều chế Iot Trong CN, người ta sản xuất iot từ rong biển. |
5. Hoạt động luyện tập
a. Mục tiêu:
- Củng cố, khắc sâu kiến thức đã học trong bài về tính chất vật lí, trạng thái tự nhiên của Flo,brom, iot và tính chất hóa học của các đơn chất.
- Tiếp tục phát triển năng lực: tính toán, sáng tạo, giải quyết các vấn đề thực tiễn thông qua kiến thức môn học, vận dụng kiến thức hóa học vào cuộc sống.
b. Phương pháp: sử dụng phiếu học tập.
c. Cách thức thực hiện:
|
Hoạt động của GV |
Hoạt động của HS |
|
- GV cho HS hoạt động cá nhân là chủ yếu, bên cạnh đó có thể cho HS hoạt động cặp đôi hoặc trao đổi nhóm nhỏ để chia sẻ kết quả giải quyết các câu hỏi/bài tập trong phiếu học tập số 3. - Hoạt động chung cả lớp: GV mời một số HS lên trình bày kết quả/lời giải, các HS khác góp ý, bổ sung. GV giúp HS nhận ra những chỗ sai sót cần chỉnh sửa và chuẩn hóa kiến thức/phương pháp giải bài tập. - Gv quan sát và đánh giá hoạt động của HS.
|
Nhận phiếu bài tập và hoàn thành phiếu bài tập.
|
PHIẾU HỌC TẬP SỐ 1
|
Nội dung |
F2 |
Cl2 |
Br2 |
I2 |
|
Tác dụng với kim loại |
|
|
|
|
|
Tác dụng với H2 |
|
|
|
|
|
Tác dụng với nước |
|
|
|
|
PHIẾU HỌC TẬP SỐ 2
NHẬN BIẾT:
Câu 1: Nhóm halogen bao gồm các nguyên tố:
A. F, Cl, Br, I. C. Cl, S, O, Si.
B. Cl, Br, Fe, I. D. O, S, Cl, N.
Câu 2: Chất nào sau đây tác dụng được với H2 ngay cả khi ở trong bóng tối và ở nhiệt độ rất thấp?
A. F2 B. Cl2 C. Br2 D. I2
Câu 3: Khi nung nóng, iot biến thành hơi không qua trạng thái lỏng. Hiện tượng này được gọi là
A. Sự bay hơi B. Sự chuyển trạng thái
C. Sự thăng hoa D. Sự phân hủy
Câu 4: Phản ứng nào có thể xảy ra được?
A. I2 + KCl B. I2 + KBr C. Br2 + KI D. Br2 + KCl
Câu 5: Để nhận biết iot, ta dùng
A. hồ tinh bột. B. quỳ tím. C. dung dịch AgNO3. D. dung dịch HCl.
Câu 8: Đặc điểm nào dưới đây là đặc điểm chung của đơn chất halogen?
A. Ở điều kiện thường là chất khí.
B. Có tính oxi hóa mạnh.
C. Vừa có tính oxi hóa vừa có tính khử.
D. Tác dụng mạnh với nước.
Câu 9: Ở điều kiện thường, chất khí nào sau đây có màu lục nhạt?
A. F2 B. Cl2 C. Br2 D. O2
THÔNG HIỂU:
Câu 9: Phản ứng nào không thể xảy ra:
A. 2Fe + 3Cl2 →2FeCl3
B. Cl2 + 2KI →2KCl + I2
C. 2Fe + 3I2 → 2FeI3
D. H2O + Cl2 → HClO + HCl
Câu 10: Dãy các đơn chất halogen nào sau đây được xếp theo thứ tự tính oxi hóa tăng dần?
A. F2, Cl2, Br2, I2 B. Cl2, Br2, I2, F2 C. Cl2, F2, Br2, I2 D. I2, Br2, Cl2, F2
Câu 11: Xét phản ứng: HCl + KMnO4 → Cl2 + MnCl2 + H2O + KCl
Trong phản ứng này vai trò của HCl là
A. Chất oxi hóa.
B. Vừa là chất oxi hóa, vừa là chất khử.
C. Chất tạo môi trường.
D. Chất khử.
Câu 12: Phát biểu nào sau đây đúng?
A. Clo tác dụng với tất cả các kim loại.
B. Ở điều kiện thường, iot tồn tại ở thể lỏng.
C. Clo có tính oxi hóa mạnh hơn Iot.
D. Flo có tính oxi hóa yếu hơn clo.
Câu 13: Trộn dung dịch chứa a gam HBr với dung dịch chứa a gam NaOH. Nhúng giấy quỳ tím vào dung dịch thu được, màu của quỳ tím sẽ là
A. chuyển sang màu đỏ. B. chuyển sang màu xanh.
C. không đổi màu. D. mất màu.
Câu 14: Trường hợp nào không xảy ra phản ứng hóa học?
A. Fe tác dụng NaI tạo ra sắt (II)iotua.
B. Cho I2 vào dung dịch NaBr.
C. Sục khí Cl2 vào dung dịch NaBr.
D. Sục khí Cl2 vào dung dịch FeCl2.
VẬN DỤNG THẤP: (4 câu)
Câu 15: Cho 15,8g KMnO4 tác dụng hoàn toàn với dung dịch HBr đặc, dư. Thể tích khí thu được ở đktc là
A. 2,24 lít. B. 5,6 lít. C. 3,36 lít. D. 4,48 lít.
Câu 16: Cho 1,27g iot tác dụng vừa đủ với lượng sắt thu được m g muối. Khối lượng muối thu được là
A. 15,5g. B. 1,55g. C. 3,1g. D. 31g.
Câu 17: Dẫn V lít khí clo qua dd muối natribromua dư thu được 48g brom, biết khí đo được ở điều kiện tiêu chuẩn. Giá trị của V là
A. 6,72. B. 6,67. C. 13,44. D. 3,36.
Câu 18: Cho 10,5g NaI vào 50ml dd nước brom 0,5M. Khối lượng NaBr thu được là
A. 3,45g B. 4,67g C. 5,15g D. 8,75g
Câu 19: Khi cho m (g) kim loại canxi tác dụng hoàn toàn với 17,92 lít khí X2 (dktc) thì thu được 88,8 g muối halogenua. X2 là chất nào?
A. Cl2 B. I2 C. Br2 D. F2
VẬN DỤNG CAO : (1 câu)
Câu 20: Cho 8,7 gam MnO2 tác dụng hết với dung dịch HCl đặc, dư thu được khí X. Cho 13 gam kẽm tác dụng với dd HCl dư thu được khí Y. Trộn toàn bộ X với Y, rồi đốt nóng trong bình kín đến phản ứng hoàn toàn, sau đó hòa tan hết sản phẩm thu được vào 100g nước thi thu được dd Z. Tính nồng độ % chất tan trong Z?
A. 6,8%. B. 7,3%. C. 14,6%. D. 12,74%.