Tailieumoi.vn xin giới thiệu đến các quý thầy cô Giáo án Hóa học 10 bài 23 hợp chất halogen mới nhất theo mẫu Giáo án môn Hóa học chuẩn của Bộ Giáo dục. Hi vọng tài liệu này sẽ giúp thầy/cô dễ dàng biên soạn chi tiết Giáo án môn Hóa học lớp 10. Chúng tôi rất mong sẽ được thầy/cô đón nhận và đóng góp những ý kiến quý báu của mình.
Mời các quý thầy cô cùng tham khảo và tải về chi tiết tài liệu dưới đây:
Tiết 43-46: Một số hợp chất của halogen.
Người soạn Nguyễn Thị Quỳnh Trang
I. Mục tiêu
1. Kiến thức
HS:
- Trình bày được cấu tạo phân tử, tính chất vật lý và tính chất hóa học của hidro clorua và axit clohidric
- Giải thích được các tính chất hoá học của axit clohidric.
- Trình bày được: Nước gia – ven là gì? Tính chất vật lí, ứng dụng và điều chế nước gia – ven (trong PTN và trong CN). Clorua vôi là gì? Công thức phân tử, công thức cấu tạo, số oxi hóa của clo trong phân tử clorua vôi, tính chất vật lí, ứng dụng và cách điều chế clorua vôi.
2. Kĩ năng
- Dự đoán tính chất, kiểm tra, kết luận được về tính chất hoá học của HCl.
- Làm một số thí nghiệm về khí hiđro clorua và axit clohiđric.
- Quan sát thí nghiệm, hình ảnh...rút ra được nhận xét về tính chất, điều chế.
- Viết phương trình hóa học minh hoạ tính chất và điều chế.
- Làm các bài tập về khí hiđro clorua và axit clohiđric.
- Trình bày được thành phần của nước gia – ven và clorua vôi.
- Tính được lượng chất cần để điều chế nước gia – ven và clorua vôi.
- Giải thích được một số ứng dụng có liên quan về nước gia – ven và clorua vôi trong thực tế.
3. Thái độ
- Say mê, hứng thú, tự chủ trong học tập; trung thực; yêu khoa học.
- Vận dụng những kiến thức đã học về axit clohidric giải quyết một số vấn đề liên quan đến hóa học trong cuộc sống, sản xuất.
- Nhận thức được vai trò quan trọng của nước gia – ven và clorua vôi, có ý thức vận dụng kiến thức đã học về nước gia – ven và clorua vôi vào thực tiễn cuộc sống.
- Nâng cao ý thức bảo vệ môi trường.
- Sử dụng clorua vôi và nước gia – ven một cách an toàn, tiết kiệm và hiệu quả.
4. Định hướng năng lực
- Năng lực sử dụng ngôn ngữ hóa học.
- Năng lực thực nghiệm hoá học.
- Năng lực giải quyết vấn đề.
- Năng lực hợp tác.
- Năng lực vận dụng kiến thức hóa học vào cuộc sống.
- Năng lực sáng tạo,
5. Phương pháp dạy học và kĩ thuật dạy học
Sử dụng phối hợp các phương pháp sau:
- Phương pháp đàm thoại tìm tòi.
- Phương pháp thuyết trình.
- Phương pháp dạy học hợp tác.
- Phương pháp trực quan.
II. Chuẩn bị
1. Giáo viên
- Giáo án word, giáo án power point, phiếu học tập cho HS.
- Video thí nghiệm.
- Máy tính, máy chiếu.
2. Học sinh
Xem lại kiến thức về liên kết hoá học và đọc trước bài.
III. Tiến trình dạy học
1. Hoạt động 1: Vào bài
a, Mục tiêu: Đặt vấn đề, dẫn dắt vào bài, tạo hứng thú cho học sinh.
b, Cách thức thực hiện: tham gia trò chơi “ bức tranh bí ẩn”.
HS chọn 1 ô chữ bất kì và trả lời các câu hỏi ở mỗi ô chữ.
Câu hỏi 1: Trong bảng tuần hoàn hóa học nguyên tố nào có hiệu nguyên tử bằng 1? Đáp án: hidro
Câu hỏi 2: Điền vào chỗ trống: Trong vật lý, bốn trạng thái tồn tại cơ bản của vật chất gồm: rắn, …..., khí, plasma. Đáp án: lỏng
Câu hỏi 3: Nguyên tố halogen nào tồn tại ở trạng thái khí, màu vàng lục, mùi xốc, rất độc? Đáp án : clo
Câu hỏi 4: Điền vào chỗ trống; dung dịch …. Làm quỳ tím chuyển đỏ. Đáp án : axit
Sau khi trả lời các câu hỏi, giáo viên đưa ra từ khóa và sẽ dẫn dắt vào bài học:
Thức ăn của chúng ta vốn được tạo nên từ những chất có khối lượng phân tử rất lớn như tinh bột, chất đạm hay chất béo. Ta chỉ có thể hấp thụ được những hợp chất này nhờ có axit clohidric trong dạ dày. Nồng độ axit thích hợp sẽ giúp chuyển hoá các chất trong thức ăn thành các chất đơn giản hơn để cơ thể có thể hấp thụ. Không chỉ vậy, trong công nghiệp, axit clohidric dùng để điều chế nhiều hóa chất quan trọng khác. Vậy hidro clorua và dung dịch tạo thành khi hoà tan vào nước của nó (axit clohidric) có những tính chất vật lý, hóa học gì? Nó được điều chế ra sao? Hôm nay chúng ta sẽ cùng tìm hiểu về nội dung này.
2. Hoạt động 2: nghiên cứu về tính axit của axit halogenhidric.
a, Mục tiêu: so sánh được tính axit của các axit halogenhidric.
b, Cách thức thực hiện
Gv yêu cầu học sinh dự đoán tính axit của các axit halogenhidric.
HS dự đoán tính axit.
Gv kết luận lại: Dung dịch HF là axit yếu còn các dung dịch HCl, HBr, HI đều là các axit mạnh.
HF HCl HBr HI
Tính axit tăng
3. Hoạt động3 : Tìm hiểu cấu tạo phân tử hidro clorua
a, Mục tiêu: HS trình bày được cấu tạo phân tử của hidro clorua.
b, Phương pháp: Đàm thoại, thuyết trình.
|
Hoạt động của GV và HS |
Nội dung ghi bảng |
|
-GV: dựa vào kiến thức đã học về liên kết hóa học, GV yêu cầu học sinh viết công thức electron, công thức cấu tạo phân tử HCl. -HS viết cấu tạo phân tử HCl. -GV yêu cầu HS khác nhận xét, cho biết liên kết giữa H và Cl thuộc loại liên kết gì? -HS: liên kết giữa H và Cl là liên kết cộng hoá trị có cực. -GV kết luận. |
I. Hidro clorua 1. Cấu tạo phân tử H:Cl hay H – Cl
Kết luận: HCl là hợp chất cộng hóa trị có cực. |
4. Hoạt động 4 : Tìm hiểu tính chất của hidroclorua
a, Mục tiêu:
- HS trình bày được tính chất của hidroclorua.
- Dự đoán, kiểm tra dự đoán, kết luận về tính chất của hidro clorua.
b, Phương pháp: Phương pháp đàm thoại, trực quan.
|
Hoạt động của GV và HS |
Nội dung ghi bảng |
|
- GV: Cho HS nghiên cứu SGK và cho biết hidro clorua ở trạng thái gì? Màu sắc, mùi, tính độc, nặng hay nhẹ hơn không khí? - HS: Chất khí, không màu, mùi xốc, nặng hơn không khí; Là một khí độc. - GV: Hidro clorua là một chất khí, em hãy dự đoán khí hidro clorua có tan trong nước hay không? Độ tan của nó như thế nào? - HS: Dự đoán: - Tan nhiều trong nước - Tan ít trong nước - Không tan trong nước - GV trình chiếu video thí nghiệm về tính tan của khí HCl trong nước. - HS: quan sát video, nêu hiện tượng. - GV: Yêu cầu HS giải thích vì sao nước lại phun vào bình thành tia? Tại sao dung dịch thu được có màu đỏ? - GV: Nhận xét và kết luận rút ra kết luận về tính tan của khí HCl trong nước và tính chất của dung dịch thu được.
|
2. Tính chất - Chất khí, không màu, mùi xốc, độc. - Tỉ khối: nặng hơn không khí.
-Khí hidro clorua tan nhiều trong nước => dung dịch axit clohidric có tính axit. |
5. Hoạt động 5: Tìm hiểu về tính chất vật lý của axit clohidric
a, Mục tiêu: HS biết được tính chất vật lý của axit clohidric.
b, Phương pháp : Phương tiện trực quan, đàm thoại.
c, Hoạt động cụ thể:
|
Hoạt động của GV và HS |
Nội dung ghi bảng |
|
-GV: Yêu cầu HS nghiên cứu SGK, cho biết trạng thái, màu sắc, mùi, nồng độ và khối lượng riêng của axit clohidric. -HS trả lời. -GV đặt vấn đề: ngoài ra dung dịch HCl đặc “bốc khói” trong không khí ẩm. Yêu cầu HS giải thích hiện tượng “bốc khói”? -HS: do axit clohidric đặc dễ bay hơi, khí HCl thoát ra kết hợp với hơi nước trong không khí tạo ra những hạt dung dịch nhỏ như sương mù “bốc khói”. - GV: kết luận.
|
II. Axit clohidric 1.Tính chất vật lí - Chất lỏng, không màu, mùi xốc. - Ở 20oC, nồng độ đặc nhất là 37%. D= 1,19 g/cm3. -Dung dịch HCl đặc “bốc khói” trong không khí ẩm.
|
6. Hoạt động 6: Tìm hiểu về tính chất hoá học của axit clohidric
a, Mục tiêu: Biết được tính chất hoá học của axit clohidric:
- Dự đoán, kiểm tra dự đoán, kết luận được tính chất hóa học của dung dịch HCl.
- Viết các phương trình hóa học và chứng minh tính axit, tính khử của dung dịch HCl.
b, Phương pháp: Phương pháp trực quan, kiểm chứng và dạy học hợp tác.
c, Hoạt động cụ thể:
|
Hoạt động của GV và HS |
Nội dung ghi bảng |
|
- GV: Yêu cầu học sinh dựa vào kiến thức đã học ở lớp 9, nêu tính chất hoá học chung của axit và dự đoán tính chất hoá học của axit clohidric. - HS trả lời. - GV cho HS xem video kiểm chứng: thí nghiệm giữa dung dịch HCl loãng với quỳ tím, CuO, NaOH, CaCO3, Fe - HS nêu hiện tượng và lên bảng viết PTHH. - GV nhận xét và yêu cầu học sinh rút ra tính chất của axit clohidric. - HS thảo luận và rút ra nhận xét về tính axit của dung dịch HCl. - GV: Nguyên nhân gây nên tính axit trên? - HS trả lời.
-GV đặt vấn đề : Trong các phản ứng trên, chúng ta đã xét về vai trò của ion H+ còn ion Cl- thì sao? Dựa vào số oxi hoá của Cl trong HCl, yêu cầu HS dự đoán tính chất của HCl. Từ đó cho biết HCl có khả năng phản ứng được với chất nào? Lấy ví dụ.
- HS: Trong phân tử HCl, nguyên tố clo có số oxi hoá thấp nhất là -1 =>HCl có tính khử => có khả năng tác dụng với chất oxi hoá mạnh như MnO2, KMnO4 ,… - GV yêu cầu HS viết PTHH và xác định vai trò của Cl- (HCl) trong phản ứng. - HS viết PTHH, xác định số oxi hoá, từ đó xác định vai trò của Cl- (HCl) trong phản ứng. - GV: Nhận xét và rút ra kết luận.
- GV nhắc lại và tổng kết tính chất hoá học của HCl theo sơ đồ.
|
II. Axit clohidric 1.Tính chất vật lí 2. Tính chất hoá học - Làm quỳ tím chuyển đỏ. - Tác dụng với oxit bazo. - Tác dụng với bazo. - Tác dụng với muối. - Tác dụng với kim loại ( đứng trước H trong dãy hoạt động hoá học). à thể hiện tính oxh
⇨ Dung dịch axit clohidric là axit mạnh, có đầy đủ tính chất hoá học chung của axit. (do ion H+ gây nên).
-HCl có tính khử khi tác dụng với chất oxi hoá mạnh. (do Cl- Clo + 1e ).
H+Cl-
Tính axit Tính khử (do ion H+) (do ion Cl-) |
7. Hoạt động 7: Tìm hiểu cách điều chế HCl
a, Mục tiêu:
- Trình bày được các điều chế khí hidro clorua trong phòng thí nghiệm và trong công nghiệp.
- Rèn được năng lực tự học, hợp tác, sử dụng ngôn ngữ hóa học, kĩ năng quan sát thí nghiệm.
b, Phương pháp: pp trực quan và đàm thoại.
c, Cách thực hiện:
|
Hoạt động của GV và HS |
Nội dung ghi bảng |
|
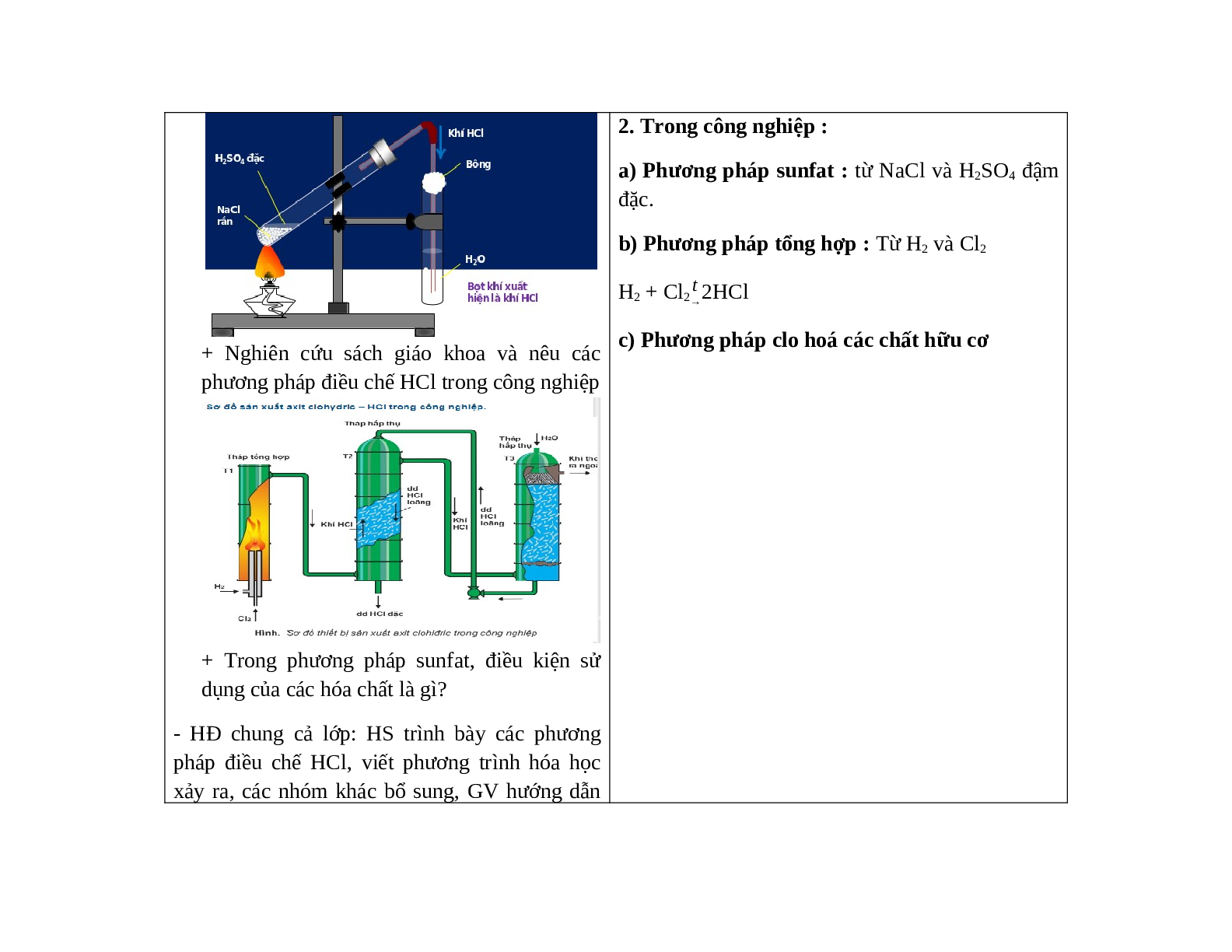
- GV cho HS xem clip thí nghiệm điều chế khí HCl và dung dịch axit clohidric. Nêu hiện tượng xảy ra, dung dịch thu được là dung dịch gì? + Nghiên cứu sách giáo khoa và nêu các phương pháp điều chế HCl trong công nghiệp + Trong phương pháp sunfat, điều kiện sử dụng của các hóa chất là gì? - HĐ chung cả lớp: HS trình bày các phương pháp điều chế HCl, viết phương trình hóa học xảy ra, các nhóm khác bổ sung, GV hướng dẫn HS chuẩn hóa kiến thức.
|
IV. Điều chế. 1. Trong phòng thí nghiệm : (phương pháp sunfat) 2. Trong công nghiệp : a) Phương pháp sunfat : từ NaCl và H2SO4 đậm đặc. b) Phương pháp tổng hợp : Từ H2 và Cl2 H2 + Cl2 2HCl c) Phương pháp clo hoá các chất hữu cơ
|
8. Hoạt động 8: nghiên cứu về muối clorua và nhận biết ion clorua.
a, Mục tiêu:
- Nêu được tính chất, ứng dụng của một số muối clorua, phản ứng đặc trưng của ion clorua.
- Biết cách nhận biết ion clorua.
b, Phương pháp: đàm thoại và thuyết trình.
c, Cách thức thực hiện.
|
Hoạt động của GV và học sinh |
Nội dung ghi bảng. |
|
- GV cho HS thảo luận: (1) Thế nào là muối clorua? (2) Tính tan của muối clorua? (Hs trả lời dựa vào bảng tính tan). - GV đưa ra cách nhận biết ion halogen.
|
III. Muối clorua, nhận biết ion clorua. 1. Muối clorua: - Muối clorua là muối của axit clohiđric. - Đa số muối clorua đều dễ tan trong nước, một vài muối không tan : AgCl (kết tủa trắng), PbCl2(kết tủa trắng, không tan trong nước lạnh, tan khá nhiều trong nước nóng), … 3. Nhận biết ion halogen : dùng AgNO3 làm thuốc thử: AgNO3 + NaF à không tác dụng AgNO3 + NaCl→ AgCl↓ + NaNO3 Màu trắng AgNO3 + NaBr→ AgBr↓ + NaNO3 Màu vàng nhạt AgNO3 + NaI→ AgI↓ + NaNO3 Màu vàng
|
9. Hoạt động 8: tìm hiểu về nước giaven và clorua vôi.
a, Mục tiêu:
- Trình bày được: Nước gia – ven là gì? Ứng dụng và điều chế nước gia – ven (trong PTN và trong CN). Clorua vôi là gì? Công thức phân tử, công thức cấu tạo, số oxi hóa của clo trong phân tử clorua vôi, tính chất vật lí, tính chất hóa học, ứng dụng và cách điều chế clorua vôi.
- Giải thích được: tính oxi hóa mạnh của clorua vôi (có tính sát trùng , tẩy trắng sợi, vải, giấy, ...).
b, phương pháp: đàm thoại và thuyết trình.
c, Hoạt động:
|
Hoạt động của GV và HS |
Nội dung ghi bảng
|
|||||||||||||||||||||||||||||||||||||||||||||
|
- Gv yêu cầu HS nghiên cứu và trả lời các câu hỏi: 1/Em hãy cho biết nước gia – ven và clorua vôi là gì? Nêu cụ thể thành phần hóa học và xác định số oxi hóa của clo trong nước gia – ven và clorua vôi.
2/ Nêu tính chất vật lí của nước gia – ven và clorua vôi.
- HS nghiên cứu sgk và hoàn thiện bảng. - Gv yêu cầu học sinh nghiên cứu và đưa ra cách điều chế . - hs nghiên cứu và tl. |
1.Khái niệm và thành phần.
2.Tính chất vật lý.
3. Điều chế:
|
10. Củng cố
- GV nhấn mạnh nội dung trọng tâm bài học
- BTVN: Làm các bài tập trang 106, 1, 2, 8, 9 , 10 ( trang 113), các bt trang 118 và 119.
Xác nhận của GV hướng dẫn