Tailieumoi.vn xin giới thiệu Trắc nghiệm Hóa học lớp 10 Bài 3: Nguyên tố hóa học sách Cánh diều. Bài viết gồm 20 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm Hóa học 10. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 3: Nguyên tố hóa học. Mời các bạn đón xem:
Trắc nghiệm Hóa học 10 Bài 3: Nguyên tố hóa học
Phần 1: Trắc nghiệm Nguyên tố hóa học
Câu 1. Kí hiệu nguyên tử cho biết
A. kí hiệu hóa học của nguyên tố (X);
B. số hiệu nguyên tử (Z);
C. số khối (A);
D. Cả A, B và C đều đúng.
Đáp án: D
Giải thích: Kí hiệu nguyên tử cho biết kí hiệu hóa học của nguyên tố (X); số hiệu nguyên tử (Z); số khối (A).
Câu 2. Cho kí hiệu nguyên tử . Khẳng định nào sau đây sai?
A. Kí hiệu hóa học của nguyên tố là O;
B. Số hiệu nguyên tử là 16;
C. Số proton trong một hạt nhân nguyên tử là 8;
D. Số neutron trong một hạt nhân nguyên tử là 8.
Đáp án: B
Giải thích:
Kí hiệu nguyên tử cho biết:
- Kí hiệu hóa học của nguyên tố là O;
- Số hiệu nguyên tử Z = 8 ⇒ số proton là 8.
- Số khối A = 16 mà A = Z + N ⇒ N = A – Z = 16 – 8 = 8 ⇒ số neutron là 8.
Vậy khẳng định: Số hiệu nguyên tử là 16 là khẳng định sai.
Câu 3. Một nguyên tử sodium (Na) có 11 e; 11p và 12n. Kí hiệu của nguyên tử này là
A. ;
B.
C. ;
D. .
Đáp án: C
Giải thích:
Một nguyên tử sodium (Na) có:
- Số hiệu nguyên tử Z = số p = 11
- Số khối A = Z + N = số p + số n = 11 + 12 = 23
Kí hiệu nguyên tử là .
Câu 4. Cho nguyên tử iron (Fe) có kí hiệu nguyên tử là . Số hạt electron, proton, neutron trong một nguyên tử này lần lượt là
A. 26; 26; 56
B. 26; 26; 30
C. 30; 30; 26
D. 30; 26; 26
Đáp án: B
Giải thích:
Kí hiệu nguyên tử là
Ta có: số e = số p = Z = 26
Số n = N = A – Z = 56 – 26 = 30
Vậy số e, p, n lần lượt là: 26; 26; 30
Câu 5. Phát biểu nào sau đây là đúng?
A. Những nguyên tử có cùng số electron thuộc cùng một nguyên tố hóa học;
B. Hai nguyên tử A và B đều có số khối là 14. Vậy hai nguyên tử này thuộc cùng một nguyên tố hóa học;
C. Những nguyên tử có cùng số neutron thuộc cùng một nguyên tố hóa học;
D. Cả A, B và C đều sai.
Đáp án: A
Giải thích:
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số hạt proton.
Mà trong nguyên tử số p = số e.
Nên những nguyên tử có cùng số electron thuộc cùng một nguyên tố hóa học là phát biểu đúng.
Câu 6. Nguyên tố hóa học là
A. tập hợp các nguyên tử có cùng số hạt neutron;
B. tập hợp các nguyên tử có cùng số hạt proton;
C. tập hợp các nguyên tử có cùng số hạt neutron và proton;
D. tập hợp các nguyên tử có cùng số số lớp electron.
Đáp án: B
Giải thích: Nguyên tố hóa học là tập hợp các nguyên tử có cùng số hạt proton.
Câu 7. Cho các nguyên tử X, Y, Z biết:
Nguyên tử X có 6 electron; 6 proton và 6 neutron.
Nguyên tử Y có 6 electron; 6 proton và 7 neutron.
Nguyên tử Z có 7 electron; 7 proton và 7 neutron.
Các nguyên tử cùng thuộc một nguyên tố hóa học là:
A. X và Y;
B. Y và Z;
C. X và Z;
D. X, Y và Z.
Đáp án: A
Giải thích:
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số hạt proton.
Mà nguyên tử X và Y đều có cùng số proton là 6. Nên X và Y cùng thuộc một nguyên tố hóa học.
Câu 8. Số hiệu nguyên tử là
A. số neutron trong một hạt nhân nguyên tử, kí hiệu là Z;
B. số proton trong một hạt nhân nguyên tử, kí hiệu là Z;
C. tổng số proton và neutron trong một hạt nhân nguyên tử, kí hiệu là Z;
D. tổng số proton và electron trong một nguyên tử, kí hiệu là Z.
Đáp án: B
Giải thích: Số hiệu nguyên tử là số proton trong một hạt nhân nguyên tử, kí hiệu là Z.
Câu 9. Nguyên tử potassium (K) có 19 electron; 19 proton và 20 neutron. Số hiệu nguyên tử của K là
A. ZK = 20;
B. ZK = 19;
C. ZK = 39;
D. ZK = 38.
Đáp án: B
Giải thích:
Số hiệu nguyên tử là số proton trong một hạt nhân nguyên tử, kí hiệu là Z.
Nên ZK = 19.
Câu 10. Số khối là
A. tổng số proton (Z) và neutron (N) trong một hạt nhân nguyên tử, kí hiệu là A;
B. tổng số proton (Z) và electron (E) trong một hạt nhân nguyên tử, kí hiệu là A;
C. số proton trong một hạt nhân nguyên tử, kí hiệu là Z;
D. số neutron trong một hạt nhân nguyên tử, kí hiệu là N.
Đáp án: A
Giải thích:
Số khối là tổng số proton (Z) và electron (E) trong một hạt nhân nguyên tử, kí hiệu là A.
A = Z + N
Câu 11. Các nguyên tử của cùng một nguyên tố hóa học
A. có số neutron khác nhau là đồng vị của nhau;
B. có số proton khác nhau là đồng vị của nhau;
C. có số electron khác nhau là đồng vị của nhau;
D. có điện tích hạt nhân khác nhau là đồng vị của nhau;
Đáp án: A
Giải thích: Các nguyên tử của cùng một nguyên tố hóa học có số neutron khác nhau là đồng vị của nhau;
Câu 12. Tổng số hạt trong nguyên tử nguyên tố X là 82. Trong đó, số hạt mang điện nhiều hơn số hạt không mang điện là 22. Kí hiệu nguyên tử X là:
(Cho số hiệu nguyên tử của Cr = 24; Mn = 25; Fe = 26; Zn = 30)
A.;
B.;
C.;
D..
Đáp án: B
Giải thích:
Gọi số hạt proton, neutron, electron trong một nguyên tử X lần lượt là p, n, e.
Ta có: p = e
Tổng số hạt trong nguyên tử X là: p + n + e = 2p + n = 82 (1)
Tổng số hạt mang điện trong nguyên tử là: p + e = 2p
Số hạt không mang điện trong nguyên tử là: n
Số hạt mang điện nhiều hơn số hạt không mang điện là 22 nên 2p – n = 22 (2)
Từ (1) và (2) ta có hệ phương trình: 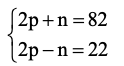
Giải hệ phương trình ta được p = 26; n = 30
Vì số hiệu nguyên tử Z = số p ⇒ Z = 26
⇒ X có kí hiệu hóa học là Fe.
Số khối: A = Z + N = 26 + 30 = 56
Kí hiệu nguyên tử của X là
Câu 13. Nguyên tố bromine có 2 đồng vị chiếm 49,5% về số lượng nguyên tử, còn lại là . Nguyên tử khối trung bình của bromine là:
A. 80;
B. 80,1;
C. 80,01;
D. 35.
Đáp án: C
Giải thích:
Thành phần phần trăm về số lượng nguyên tử của đồng vị là:
100% − 49,5% = 50,5%
Nguyên tử khối trung bình của bromine là:
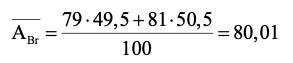
Câu 14. Lithium có 2 đồng vị là 7Li và 6Li.Nguyên tử khối trung bình của Li là 6,93. Phần trăm số nguyên tử của đồng vị 7Li là:
A. 93%;
B. 7%;
C. 78%;
D. 22%.
Đáp án: A
Giải thích:
Gọi phần trăm số nguyên tử của đồng vị 7Li là x%
⇒ phần trăm số nguyên tử của đồng vị 6Li là (100 − x)%
Ta có: 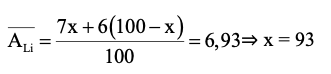
Phần trăm số nguyên tử của đồng vị7Li là 93%.
Câu 15. Trong tự nhiên, đồng có hai đồng vị bền là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,54. Số mol đồng vị 65Cu có trong 6,354 gam đồng là
A. 0,073 mol;
B. 0,1 mol;
C. 0,027 mol;
D. 0,065 mol;
Đáp án: C
Giải thích:
nCu = = 0,1 (mol)
Gọi phần trăm số nguyên tử của đồng vị 65Cu là x%
⇒ phần trăm số nguyên tử của đồng vị 63Cu là (100 − x)%
Ta có: 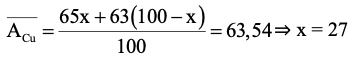
Số mol đồng vị 65Cu có trong 6,354 gam đồng là: 0,1.27% = 0,027 (mol).
Phần 2: Lý thuyết Nguyên tố hóa học
I. Nguyên tố hóa học
1. Khái niệm nguyên tố hóa học
- Nguyên tố hóa học là tập hợp các nguyên tử có cùng số hạt proton.
Ví dụ: Ba loại nguyên tử trong hình dưới đây đều có một proton (hạt màu xanh) trong hạt nhân nên thuộc cùng một nguyên tố hóa học, nguyên tố hydrogen (H).
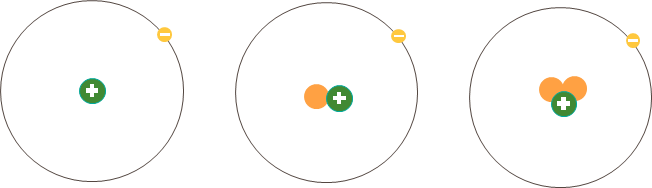
Hình 3.1. Minh họa cấu tạo một số loại nguyên tử của nguyên tố hydrogen
2. Số hiệu nguyên tử, số khối, kí hiệu nguyên tử
- Số proton trong một hạt nhân nguyên tử được gọi là số hiệu nguyên tử, kí hiệu là Z.
Ví dụ: Hạt nhân nguyên tử lithium (Li) có 3 proton, vậy số hiệu nguyên tử của Li là 3 (ZLi = 3).
- Tổng số proton (Z) và neutron (N) trong một hạt nhân nguyên tử được gọi là số khối, kí hiệu là A.
A = Z + N
Như vậy, số khối chính bằng tổng số hạt có trong hạt nhân nguyên tử. Giá trị này xấp xỉ bằng giá trị khối lượng nguyên tử (tính theo đơn vị amu).
Ví dụ: Một loại nguyên tử sodium (Na) có 11 hạt proton, 11 electron và 12 hạt neutron. Số khối của nguyên tử Na = Z + N = P + N = 11 + 12 = 23 (amu)
- Kí hiệu nguyên tử cho biết kí hiệu hóa học của nguyên tố (X), số hiệu nguyên tử (Z) và số khối (A).

Hình 3.2. Kí hiệu nguyên tử của helium
Lưu ý: Đôi khi, người ta viết tắt kí hiệu nguyên tử.
Ví dụ: Sử dụng 4He thay cho , bởi kí hiệu He đã cho biết đây là nguyên tử nguyên tố helium, hạt nhân có 2 proton.
II. Đồng vị, nguyên tử khối trung bình
1. Đồng vị
- Các nguyên tử của cùng một nguyên tố hóa học có số neutron khác nhau là đồng vị của nhau.
Do đó, đồng vị của cùng một nguyên tố hóa học (có cùng số proton) khác nhau về số khối do đó số neutron khác nhau.
Ví dụ: Helium có hai đồng vị bền là và .
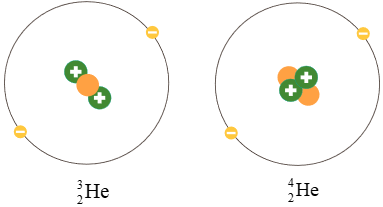
Hình 3.3. Minh họa cấu tạo nguyên tử hai đồng vị của nguyên tố helium
- Tất cả các nguyên tố hóa học đều có nhiều đồng vị.
Ví dụ: Hydrogen có ba đồng vị là (kí hiệu là H), (kí hiệu là D), (kí hiệu là T), oxygen có 17 đồng vị bắt đầu từ và kết thúc là , ...
2. Nguyên tử khối trung bình
a) Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của một nguyên tử, cho biết khối lượng của một nguyên tử nặng gấp bao nhiêu lần 1 amu.
Ví dụ: Nguyên tử khối của 16O là 16 do khối lượng của một nguyên tử 16O là 16 amu.
b) Nguyên tử khối trung bình
- Mỗi nguyên tố hóa học đều có nhiều đồng vị.
- Trong tự nhiên, một nguyên tố hóa học dù ở dạng đơn chất hay hợp chất thì tỉ lệ giữa các đồng vị của nguyên tố này là không đổi.
- Nguyên tử khối của nguyên tố hóa học có nhiều đồng vị là nguyên tử khối trung bình của các đồng vị (kí hiệu là ![]() ), có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng (xác định từ phổ khối lượng).
), có tính đến tỉ lệ số nguyên tử các đồng vị tương ứng (xác định từ phổ khối lượng).
- Công thức tính nguyên tử khối trung bình như sau:
=
Trong đó:
+ X, Y, Z, ... lần lượt là số khối của các đồng vị.
+ x, y, z, ... là phần trăm số nguyên tử các đồng vị tương ứng.
Ví dụ: Trong tự nhiên, đồng có hai đồng vị bền là 63Cu và 65Cu chiếm tương ứng khoảng 73% và 27% về số nguyên tử. Nguyên tử khối trung bình của đồng là:
= = 63,64
Lưu ý: Nguyên tử khối của một nguyên tố hóa học ghi trong bảng tuần hoàn là nguyên tử khối trung bình của các đồng vị trong tự nhiên.
Xem thêm các bài trắc nghiệm Hóa học 10 Cánh diều hay, chi tiết khác:
Trắc nghiệm Hóa 10 Bài 2: Thành phần của nguyên tử
Trắc nghiệm Hóa 10 Bài 3: Nguyên tố hóa học
Trắc nghiệm Hóa 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Trắc nghiệm Hóa 10 Bài 5: Lớp, phân lớp và cấu hình electron
Trắc nghiệm Hóa 10 Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học