Tailieumoi.vn sưu tầm và biên soạn chuyên đề Hợp chất của cacbon gồm đầy đủ lý thuyết, các dạng bài tập chọn lọc và ví dụ minh họa từ cơ bản đến nâng cao giúp học sinh ôn luyện kiến thức, biết cách làm bài tập môn Hóa học 11.
Chuyên đề Hợp chất của cacbon
I. LÍ THUYẾT TRỌNG TÂM
Cacbon monooxit (CO)
1. Tính chất vật lí
CO là chất khí không màu, không mùi, không vị, nhẹ hơn không khí, độc.
2. Tính chất hóa học
a. CO là oxit không tạo muối (oxit trung tính): Ở to thường, không tác dụng với H2O, axit, kiềm.
b. Tính khử:
Ví dụ: .
3. Điều chế
a. Trong phòng thí nghiệm: .
b. Trong công nghiệp
Cacbon đioxit (CO2)
1. Tính chất vật lí
là chất khí không màu, nặng hơn không khí, tan không nhiều trong nước.
2. Tính chất hóa học
a. là khí không duy trì sự sống và sự cháy
Chú ý: Tuy nhiên không sử dụng để dập đám cháy do magie hoặc nhôm.
b. là oxit axit
Ví dụ:
Phản ứng (1) dùng để nhận biết .
3. Điều chế
a. Trong phòng thí nghiệm:
b. Trong công nghiệp: .
Axit cacbonic và muối cacbonat
1. Axit cacbonic (H2CO3)
a. là axit hai nấc rất yếu, kém bền phân hủy thành và H2O:
b. Tác dụng với dung dịch kiềm Muối:
2. Muối cacbonat
Muối trung hòa: muối cacbonat .
Ví dụ:
Muối axit: muối hiđrocacbonat .
Ví dụ:
a. Tính tan:
Muối cacbonat của kim loại kiềm, amoni và đa số các muối hiđrocacbonat dễ tan trong nước. Muối cacbonat của kim loại khác không tan trong nước.
b. Tác dụng với axit: dùng để nhận biết muối cacbonat:
Ví dụ:
c. Tác dụng với dung dịch kiềm:
Muối hiđrocacbonat tác dụng với dung dịch kiềm:
Ví dụ:
d. Phản ứng nhiệt phân:
Muối cacbonat của kim loại kiềm: Không bị nhiệt phân.
Muối cacbonat còn lại Oxit kim loại
Ví dụ: .
Muối hiđrocacbonat .
Ví dụ: .
HỆ THỐNG HÓA KIẾN THỨC
HỢP CHẤT CỦA CACBON
1. Cacbon monooxit (CO)
a. Tính chất hóa học:
+ CO là oxit không tạo muối (oxit trung tính).
+ Tính khử mạnh:
b. Điều chế:
+ Trong phòng thí nghiệm: .
+ Trong công nghiệp:
2. Cacbon đioxit (CO2)
a. Tính chất hóa học:
+ là oxit axit.
Ví dụ:
+ là khí không duy trì sự sống và sự cháy (trừ Mg,…)
Ví dụ:
Không dùng dập tắt đám cháy Mg, Al.
b. Điều chế:
Trong phòng thí nghiệm: .
3. Muối cacbonat
Tính chất hóa học:
Chú ý: Muối cacbonat của kim loại kiềm không bị nhiệt phân.
II. CÁC DẠNG BÀI TẬP
Dạng 1: Bài tập lí thuyết về tính chất vật lí, hóa học, ứng dụng của CO, CO2, muối cacbonat
Kiểu hỏi 1: Câu hỏi về tính chất vật lí, ứng dụng của CO,CO2 , muối cacbonat
Ví dụ mẫu
Ví dụ 1. Phát biểu nào sau đây đúng?
A. CO là chất khí không màu, không mùi, rất độc.
B. CO là chất khí không màu, mùi xốc, tan tốt trong nước.
C. CO2 là chất khí màu vàng nhạt, không mùi.
D. CO2 không được dùng trong sản xuất nước giải khát có ga.
Hướng dẫn giải
A đúng.
B sai vì CO là khí không màu, ít tan trong nước.
C, D sai vì CO2 là khí không màu, ít tan trong nước, được dùng trong sản xuất nước giải khát có ga.
Chọn A.
Ví dụ 2. CO2 không cháy và không duy trì sự cháy nhiều chất nên được dùng để dập tắt các đám cháy. Tuy nhiên, người ta không sử dụng CO2 để dập tắt:
A. đám cháy do xăng dầu.
B. đám cháy nhà cửa, quần áo.
C. đám cháy do magie hoặc nhôm.
D. đám cháy do khí gas.
Hướng dẫn giải
Không dùng CO2 để dập tắt đám cháy magie hoặc nhôm vì các kim loại mạnh như Mg, Al,… có thể cháy trong khí CO2 .
.
Chọn C.
Kiểu hỏi 2: Câu hỏi về tính chất hóa học của CO, CO2 , muối cacbonat
Ví dụ mẫu
Ví dụ 1. Phương trình hóa học nào sau đây sai?
A.
B.
C.
D.
Hướng dẫn giải
CO chỉ khử được các oxit kim loại của kim loại đứng sau Zn tạo thành kim loại và CO2 . Do đó CO không khử được .
Phương trình C sai.
Chọn C.
III. Bài tập tự luyện dạng 1
Câu 1: Sự hình thành thạch nhũ trong các hang động đá vôi là nhờ phản ứng hóa học:
A.
B.
C.
D.
Câu 2: Dẫn luồng khí CO dư qua ống sứ nung nóng đựng hỗn hợp . Sau khi phản ứng xảy ra hoàn toàn, hỗn hợp rắn còn lại trong ống sứ gồm:
A.
B.
C.
D.
Câu 3: Nhóm gồm các muối không bị nhiệt phân là:
A.
B.
C.
D.
Câu 4: Có ba hỗn hợp dung dịch:
Chỉ dùng thêm một cặp chất nào trong số các cặp chất cho dưới đây để có thể phân biệt được các dung dịch hỗn hợp trên?
A. Dung dịch và dung dịch
B. Dung dịch HCl và dung dịch .
C. Dung dịch dư.
D. Dung dịch và dung dịch
Câu 5: Có 4 chất rắn: và . Chỉ dùng thêm một cặp chất, hãy nhận biết các chất rắn trên?
Dạng 2: Khử oxit kim loại bằng C và CO
Phương pháp giải
|
Phương trình tổng quát:
|
Ví dụ: Khử 16 gam hỗn hợp các oxit kim loại: bằng khí CO ở nhiệt độ cao. Sau phản ứng, khối lượng chất rắn thu được là 11,2 gam. Tính thể tích khí CO đã tham gia phản ứng (đktc). Hướng dẫn giải Sơ đồ phản ứng:
Gọi số mol CO phản ứng là x mol. |
|
Theo phương trình |
|
|
Bảo toàn khối lượng:
|
Bảo toàn khối lượng:
Thể tích khí CO đã tham gia phản ứng là:
|
Ví dụ mẫu
Ví dụ 1. Dẫn một luồng khí CO dư qua ống sứ đựng và CuO nung nóng đến khi phản ứng hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 5 gam kết tủa. Tính tổng khối lượng hai oxit trong hỗn hợp đầu.
Hướng dẫn giải
Phương trình hóa học:
Bảo toàn nguyên tố C:
Bảo toàn khối lượng:
IV. Bài tập tự luyện dạng 2
Câu 1: Cho luồng khí CO dư đi qua 9,1 gam hỗn hợp gồm CuO và , nung nóng đến khi phản ứng xảy ra hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO trong hỗn hợp đầu là:
A. 0,8 gam. B. 8,3 gam.
C. 2,0 gam. D. 4,0 gam.
Câu 2: Cho V lít hỗn hợp khí (ở đktc) gồm CO và H2 phản ứng với một lượng dư hỗn hợp rắn gồm CuO và nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là:
A. 0,112. B. 0,560.
C. 0,224. D. 0,448.
Câu 3: Cho khí CO đi qua m gam nung nóng thì được 10,68 gam chất rắn X và khí Y. Cho toàn bộ khí Y hấp thụ vào dung dịch dư thì thấy tạo ra 3 gam kết tủa. Giá trị của m là:
A. 12,00. B. 11,58.
C. 11,16. D. 12,20.
Câu 4: Khử 16 gam hỗn hợp các oxit kim loại: và PbO bằng khí CO ở nhiệt độ cao, khối lượng chất rắn thu được là 11,2 gam. Tính thể tích khí CO đã tham gia phản ứng ở điều kiện tiêu chuẩn.
Dạng 3: Bài tập CO2 tác dụng với dung dịch kiềm
Phương pháp giải
|
Phương trình hóa học:
|
Ví dụ: Sục 4,48 lít khí CO2 (đktc) vào 500 ml dung dịch NaOH 0,1M và 0,2M. Tính khối lượng kết tủa thu được Hướng dẫn giải |
|
Bước 1: Tính |
|
|
Bước 2: Xét tỉ lệ
Bước 3: Tính toán theo yêu cầu của đề bài. |
Xét tỉ lệ: Nhận thấy: nên phản ứng tạo hai muối và . |
|
Cách 1: Tính theo phương trình hóa học. Ngoài ra, còn có thể áp dụng các định luật bảo toàn để tính toán. |
Cách 1: Phương trình hóa học:
Gọi số mol và lần lượt là x và y mol. Bảo toàn nguyên tố C: Theo phương trình: Từ (1) và (2) suy ra: |
|
Cách 2: Công thức giải nhanh:
|
Cách 2: Ta có:
|
|
Chú ý: So sánh và để đem kết tủa tính theo chất nào. Chú ý: Có những bài toàn không thể tính T. Khi đó phải dựa vào những dữ kiện phụ để tìm ra khả năng tạo muối: |
Phương trình hóa học:
|
|
CO2 tác dụng với NaOH, KOH |
|
|
Hấp thụ CO2 vào NaOH dư (KOH dư) chỉ tạo muối trung hòa Hấp thụ CO2 vào NaOH, sau đó thêm vào thấy kết tủa. Thêm tiếp dư vào thấy xuất hiện thêm kết tủa nữa Tạo cả hai muối và . Chất hấp thụ vào bình NaOH tăng:
|
|
|
CO2 tác dụng với Ca(OH)2,Ba(OH)2 |
|
|
Hấp thụ CO2 vào nước vôi dư/ dư thì chỉ tạo muối (kết tủa). Hấp thụ CO2 vào nước vôi trong/ thấy có kết tủa, thêm dư vào thấy có kết tủa nữa suy ra có sự tạo cả và Hấp thụ CO2 vào nước vôi trong/ thấy có kết tủa, lọc bỏ kết tủa rồi đun nóng nước lọc lại thấy kết tủa nữa suy ra có sự tạo cả và . Sự tăng giảm khối lượng dung dịch: Khi cho sản phẩm cháy vào bình hay :
|
Ví dụ mẫu
Ví dụ 1. Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào 3 lít dung dịch 0,03M. Khối lượng kết tủa thu được sau phản ứng là:
A. 0,8 gam. B. 8,3 gam.
C. 3,0 gam. D. 5,0 gam.
Hướng dẫn giải
Xét tỉ lệ:
Nhận thấy: nên phản ứng tạo hai muối và .
Cách 1: Phương trình hóa học:
Gọi số mol và lần lượt là x và y mol.
Bảo toàn nguyên tố C:
Theo phương trình:
Từ (1) và (2) suy ra:
Cách 2: Ta có:
Phương trình hóa học:
Chọn C.
Bài toán 2: Bài toán nghịch: Xác định chất tham gia
Phương pháp giải
|
Cho x mol CO2 tác dụng với a mol OH- tạo thành b kết tủa (hoặc b mol muối trung hòa). Tìm giá trị x biết a, b. |
Ví dụ: Cho V lít CO2 (đktc) tác dụng với 250 ml dung dịch 0,5M tạo thành 19,7 gam kết tủa. Tính giá trị của V. Hướng dẫn giải |
|
Bước 1: Tính hoặc số mol muối trung hòa. |
|
|
Bước 2: Viết phương trình hóa học.
|
Phương trình hóa học:
|
|
Bước 3: Tính toán theo yêu cầu của đề bài. Nếu a = 2b thì bài toán rất đơn giản x=b. Nếu a > 2b thì bài toán có thể có hai đáp số vì xảy ra hai trường hợp: |
Nhận thấy: xảy ra hai trường hợp: |
|
TH1: OH- dư, tức là chỉ xảy ra phản ứng (1): |
TH1: OH- dư chỉ xảy ra phản ứng (1). Ta có: |
|
TH2: Xảy ra 2 phản ứng (1), (2) ta có:x = a -b |
TH2: Xảy ra cả (1) và (2) Tạo thành hai muối và . Ta có: Vậy V có hai giá trị là 2,24 hoặc 3,36. |
Ví dụ mẫu
Ví dụ 1: Cho V lít CO2 (đktc) vào 3,5 lít 0,02M, sau phản ứng thu được 5 gam kết tủa. Giá trị của V là:
A. 2,240 hoặc 2,016. B. 1,680 hoặc 2,016.
C. 1,120 hoặc 2,016. D. 3,360 hoặc 2,016.
Hướng dẫn giải
Phương trình hóa học:
Nhận thấy: xảy ra hai trường hợp.
TH1: OH- dư chỉ xảy ra phản ứng (1).
Ta có:
TH2: Xảy ra cả (1) và (2) Tạo thành hai muối và .
Ta có:
Chọn C.
V. Bài tập tự luyện dạng 3
Câu 1: Hấp thụ hoàn toàn 2,24 lít CO2 (đktc) vào dung dịch nước vôi trong có chứa 0,25 mol . Sản phẩm muối thu được sau phản ứng gồm:
A. chỉ có .
B. chỉ có .
C. cả và .
D. Không xác định được.
Câu 2: Hấp thụ hoàn toàn 0,672 lít CO2 (đktc) vào 2 lít 0,01M thu được m gam kết tủa. Giá trị của m là:
A. 1,0. B. 1,5.
C. 2,0. D. 2,5.
Dạng 4: Bài tập về muối cacbonat
Bài toán 1: Cho từ từ axit vào muối
Phương pháp giải
|
|
Ví dụ: Nhỏ từ từ từng giọt hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa 0,2M và 0,2M. Tính số mol CO2 thu được sau phản ứng. Hướng dẫn giải |
|
Bước 1: Tính |
|
|
Bước 2: Viết phương trình hóa học và tính toán theo yêu cầu đề bài. Phản ứng xảy ra theo thứ tự:
|
Phản ứng xảy ra theo thứ tự sau:
Sau phản ứng:
Vậy số mol CO2 thu được là 0,01 mol. |
Ví dụ mẫu
Ví dụ 1: Cho từ từ đến hết 54,75 gam axit HCl 40% tác dụng với 200 ml hỗn hợp dung dịch KOH 1M và 1,5M. Sau khi các phản ứng xảy ra hoàn toàn, thu được V lít khí CO2 (đktc). Giá trị của V là:
A. 6,72. B. 4,48.
C. 5,60. D. 2,24.
Hướng dẫn giải
Thứ tự phản ứng:
Ta có:
Chọn D.
Chú ý: Cho từ từ axit vào hỗn hợp dung dịch gồm bazơ và muối thì axit sẽ phản ứng với bazơ trước rồi phản ứng với muối.
Bài toán 2: Cho từ từ muối vào axit
Phương pháp giải
|
Khi cho từ từ dung dịch muối cacbonat (hoặc hỗn hợp muối cacbonat và hiđrocacbonat) vào dung dịch axit xảy ra đồng thời:
|
Ví dụ: Trộn 150 ml dung dịch X chứa hỗn hợp gồm 1M và 0,5M với 250 ml dung dịch HCl 2M. Tính thể tích khí sinh ra (ở đktc). Hướng dẫn giải
Phương trình hóa học:
|
Ví dụ mẫu
Ví dụ 1: Dung dịch X chứa hỗn hợp gồm 1,5M và 1M. Cho từ từ 100 ml dung dịch X vào 200 ml dung dịch HCl 1M sinh ra V lít khí (đktc). Tính V.
Hướng dẫn giải
Nhận thấy: hết.
Ta có:
Gọi số mol và phản ứng lần lượt là 1,5x và x mol.
Phương trình hóa học:
Theo phương trình:
Theo phương trình: .
Bài toán 3: Muối hiđrocacbonat tác dụng với dung dịch kiềm
Phương pháp giải
|
|
Ví dụ: Cho 200 ml dung dịch 0,1M vào 300 ml dung dịch 0,1M, thu được m gam kết tủa. Giá trị của m là: A. 5,91. B. 3,94. C. 7,88. D. 11,82. Hướng dẫn giải
|
|
Phương trình hóa học:
Nếu dung dịch có thì phản ứng tạo kết tủa:
|
Phương trình hóa học:
.
Chọn B. |
Ví dụ mẫu
Ví dụ 1: Cho 6,72 lít khí CO2 (đktc) và bình chứa 300 ml dung dịch NaOH 1M. Sau khi phản ứng kết thúc thêm tiếp dung dịch NaOH dư vào bình này. Khối lượng muối thu được sau phản ứng là:
A. 28,0 gam. B. 31,8 gam.
C. 40,0 gam. D. 50,0 gam.
Hướng dẫn giải
Xét tỉ lệ Tạo muối
Phương trình hóa học:
Thêm NaOH dư vào dung dịch xảy ra phản ứng:
.
Chọn B.
Bài toán 4: Nhiệt phân muối cacbonat
![]() Phương pháp giải
Phương pháp giải
|
|
Tất cả muối hiđrocacbonat đều bị nhiệt phân:
|
Ví dụ: Nhiệt phân hoàn toàn 16,8 gam thu được m gam . Giá trị của m là: A. 21,2. B. 10,6. C. 13,2. D. 12,4. Hướng dẫn giải
Phương trình hóa học:
Chọn B. |
Ví dụ mẫu
Ví dụ 1: Nung 16,8 gam muối cacbonat của kim loại M hóa trị II thu được V lít CO2. Sục CO2 thu được vào dư được 39,4 gam kết tủa. Xác định kim loại M.
Hướng dẫn giải
Gọi công thức của muối cacbonat là .
Phương trình hóa học:
Theo (2):
Theo (1): .
Vậy M là magie (Mg).
VI. Bài tập tự luyện dạng 4
Bài tập cơ bản
Câu 1: Dung dịch X chứa hỗn hợp gồm 1,5M và 1M. Nhỏ từ từ từng giọt cho đến hết 200 ml dung dịch HCl 1M vào 100 ml dung dịch X, sinh ra V lít khí (ở đktc). Giá trị của V là:
A. 3,360. B. 11,200.
C. 0,112. D. 1,120.
Câu 2: Nhỏ từ từ từng giọt đến hết 400 ml dung dịch HCl 2M vào 100 ml dung dịch hỗn hợp chứa ( 3M và 2M), sau phản ứng thu được V lít khí CO2(đktc). Giá trị của V là:
A. 5,60. B. 8,96.
C. 11,20. D. 6,72.
Câu 3: Một loại đá vôi chứa 80% còn lại là tạp chất trơ. Nung m gam đá này một thời gian thu được 0,78m gam chất rắn. Hiệu suất phân hủy là:
A. 78,0%. B. 50,0%.
C. 62,5%. D. 97,5%.
Câu 4: Nung nóng 100 gam hỗn hợp gồm và cho đến khối lượng không đổi còn lại 69 gam chất rắn. Phần trăm khối lượng mỗi chất trong hỗn hợp ban đầu lần lượt là:
A. 63% và 37%. B. 42% và 58%.
C. 16% và 84%. D. 84% và 16%.
Bài tập nâng cao
Câu 5: Hòa tan hoàn toàn 4 gam hỗn hợp và bằng dung dịch HCl dư thấy thoát ra V lít khí (đktc). Dung dịch thu được đem cô cạn được 5,1 gam muối khan. Giá trị của V là:
A. 1,12. B. 1,68.
C. 3,36. D. 2,24.
ĐÁP ÁN
Dạng 1: Bài tập lí thuyết về tính chất vật lí, hóa học, ứng dụng của CO, CO2, muối cacbonat
Câu 1: Chọn D.
Câu 2: Chọn B.
Câu 3: Chọn B.
Câu 4: Chọn D.
|
|
|
|
|
|
Dung dịch |
Kết tủa trắng |
Kết tủa trắng |
Kết tủa trắng |
|
Dung dịch |
Kết tủa tan hết |
Kết tủa không tan |
Kết tủa tan một phần (e) |
Câu 5:
Để nhận biết bốn chất rắn trên, sử dụng H2O và khí CO2.
Sơ đồ nhận biết:
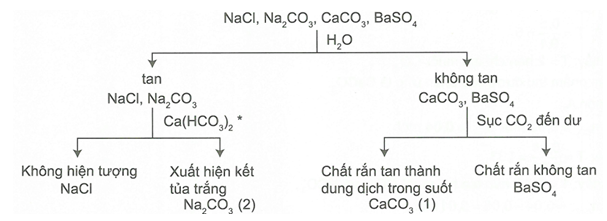
Dung dịch được lấy từ thí nghiệm (1).
Bạn đọc tự viết phương trình.
Dạng 2: Khử oxit kim loại bằng C và CO
Câu 1: Chọn D.
Gọi số mol CuO là x mol, là y mol
Phương trình hóa học:
Lại có:
Từ (1) và (2) suy ra: .
Câu 2: Chọn D.
Bản chất phản ứng:
Khối lượng chất rắn giảm là khối lượng oxi trong oxit kim loại bị tách ra.
Ta có:
Theo phương trình: .
Câu 3: Chọn C.
Bản chất phản ứng:
Theo phương trình: .
.
Câu 4:
Gọi x là số mol CO tham gia phản ứng.
Số mol
Bảo toàn khối lượng: .
Thể tích CO đã tham gia phản ứng là: .
Dạng 3: Bài tập CO2 tác dụng với dung dịch kiềm
Câu 1: Chọn A.
Ta có:
Xét tỉ lệ:
Nhận thấy nên chỉ tạo muối .
Vậy sản phẩm thu được sau phản ứng là .
Câu 2: Chọn A.
Ta có:
Xét tỉ lệ:
Nhận thấy nên tạo hai muối và .
Ta có
Phương trình hóa học:
.
Dạng 4: Bài tập về muối cacbonat
Câu 1: Chọn C.
Phương trình hóa học:
Vậy thể tích khí CO2 thoát ra là: lít.
Câu 2: Chọn D.
Phương trình hóa học:
Vậy thể tích khí CO2 thoát ra là: lít.
Câu 3: Chọn C.
Gọi số mol khí CO2 thoát ra là a mol.
Bảo toàn khối lượng:
Hiệu suất phản ứng bằng: .
Câu 4: Chọn C.
Gọi số mol lần lượt là x, y mol.
Phương trình hóa học:
Từ (1) và (2) suy ra: .
.
Câu 5: Chọn D.
Gọi số mol của và lần lượt là x và y mol.
Phương trình hóa học:
Bảo toàn khối lượng:
Thể tích khí thu được là: .









