Với tóm tắt lý thuyết Hóa học lớp 10 Bài 11: Liên kết ion sách Kết nối tri thức hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 10.
Lý thuyết Hóa học lớp 10 Bài 11: Liên kết ion
Video giải Hóa học 10 Bài 11: Liên kết ion - Kết nối tri thức
A. Lý thuyết Liên kết ion
I. Sự tạo thành ion
Kim loại điển hình phản ứng rất mạnh với phi kim điển hình tạo ra hợp chất ion. Khi đó, nguyên tử kim loại nhường electron để tạo thành ion mang điện tích dương (cation) còn nguyên tử phi kim nhận electron để trở thành ion mang điện tích âm (anion).
Ví dụ 1:
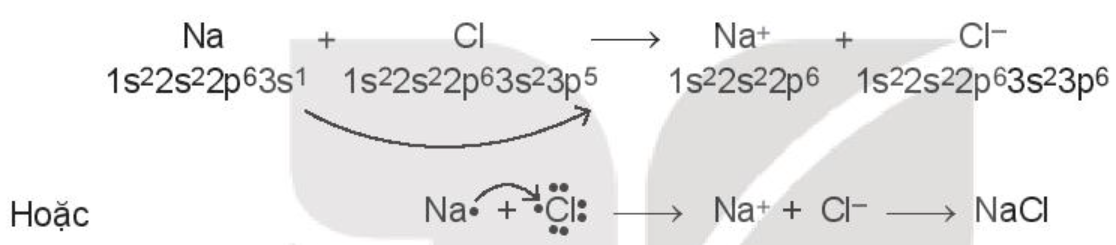
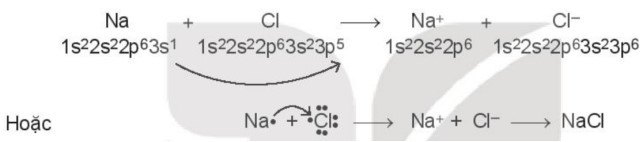
Cấu hình electron của nguyên tử Na (Z = 11): 1s22s22p63s1
Có 1 electron ở lớp ngoài cùng.
Nguyên tử Na nhường đi 1 electron ở lớp ngoài cùng để tạo thành ion dương Na+ (cation sodium).
Na Na+ + 1e
Chú ý: Số đơn vị điện tích của ion dương (cation) bằng số electron mà nguyên tử đã nhường.
Ví dụ 2:
Cấu hình electron của nguyên tử Cl (Z = 17): 1s22s22p63s23p5.
Có 7 electron ở lớp ngoài cùng.
Nguyên tử Cl nhận 1 electron để tạo thành ion âm Cl- (anion chloride).
Cl + 1e Cl-
Chú ý: Số đơn vị điện tích của ion âm (anion) bằng số electron mà nguyên tử đã nhận.
Các ion thường có cấu hình electron bền vững của nguyên tử khí hiếm gần nhất với nguyên tố tạo thành ion đó trong bảng tuần hoàn.
II. Sự tạo thành liên kết ion
Ví dụ 1: Xét sự tạo thành liên kết hóa học trong phân tử sodium chloride (NaCl):
Khi kim loại sodium kết hợp với phi kim chlorine, tạo thành các ion Na+ và Cl-, các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Ví dụ 2: Xét sự thành thành liên kết hóa học trong phân tử calcium chloride (CaCl2):
Khi kim loại calcium kết hợp với phi kim chlorine, tạo thành các ion Ca2+ và Cl-. Các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.

Kết luận:
- Lực hút tĩnh điện giữa các ion mang điện trái dấu trong phân tử (hay tinh thể) tạo ra liên kết ion.
- Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình. Các hợp chất tạo nên từ các ion được gọi là những hợp chất ion.
III. Tinh thể ion
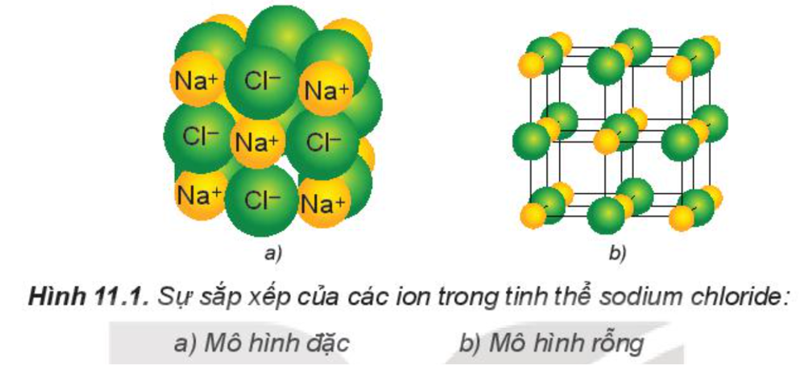
1. Cấu trúc của tinh thể ion
Các ion được sắp xếp theo một trật tự xác định trong không gian theo kiểu mạng lưới, trong đó ở các nút của mạng lưới là những ion dương và ion âm được sắp xếp luân phiên, liên kết chặt chẽ với nhau do sự cân bằng giữa lực hút (các ion trái dấu hút nhau) và lực đẩy (các ion cùng dấu đẩy nhau), tạo thành mạng tinh thể ion.
Ví dụ: Tinh thể muối ăn.
2. Độ bền và tính chất của hợp chất ion
Tron tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường.
Các tinh thể ion khá rắn chắc, nhưng khá giòn. Đây là tính chất đặc trưng của tinh thể ion.
Ví dụ: Tinh thể muối ăn ở dạng rắn, cứng, nhưng khi tác dụng một lực mạnh thì vỡ vụn.
Các hợp chất ion có khả năng dẫn điện khi tan trong nước hay khi nóng chảy.
B. Trắc nghiệm Liên kết ion
Câu 1. Hoàn thành sơ đồ tạo thành ion sau: K K+ + ?.
A. 1e.
B. 2e.
C. 3e.
D. 4e.
Đáp án: A
Giải thích:
Nguyên tử kim loại nhường electron để tạo thành ion mang điện tích dương (cation). Số đơn vị điện tích của ion dương (cation) bằng số electron mà nguyên tử đã nhường.
Sơ đồ tạo thành ion: K ® K+ + 1e.
Câu 2. Hoàn thành sơ đồ tạo thành ion sau: O +2e ?
A. O2+.
B. O2-.
C. O-.
D. O+.
Đáp án: B
Giải thích:
Nguyên tử phi kim nhận electron để tạo thành ion mang điện tích âm (anion). Số đơn vị điện tích của ion âm (anion) bằng số electron mà nguyên tử đã nhận.
Sơ đồ tạo thành ion: O +2e O2-.
Câu 3. Nguyên tử Mg có Z = 12. Cấu hình electron của ion Mg2+ là
A. 1s22s22p63s2.
B. 1s22s22p63s1.
C. 1s22s22p6.
D. 1s22s22p63s23p2.
Đáp án: C
Giải thích:
Cấu hình electron của nguyên tử Mg (Z = 12): 1s22s22p63s2.
Nguyên tử Mg nhường 2 electron để tạo thành ion Mg2+: Mg ® Mg2+ + 2e.
® Cấu hình electron của ion Mg2+ là 1s22s22p6 (giống khí hiếm Neon).
Câu 4. Nguyên tử S có Z = 16. Cấu hình electron của ion S2- là
A. 1s22s22p63s23p4.
B. 1s22s22p63s2.
C. 1s22s22p63s23p6.
D. 1s22s22p6.
Đáp án: C
Giải thích:
Cấu hình electron của nguyên tử S (Z = 16): 1s22s22p63s23p4.
Nguyên tử S nhận thêm 2 electron để tạo thành ion S2-: S + 2e ® S2-.
® Cấu hình electron của ion S2- là 1s22s22p63s23p6 (giống khí hiếm argon).
Câu 5. Liên kết ion trong phân tử hay tinh thể được tạo thành
A. nhờ lực đẩy giữa các ion âm.
B. nhờ lực hút tĩnh điện của các ion mang điện tích trái dấu.
C. nhờ lực đẩy giữa các ion dương.
D. giữa hai nguyên tử, trong đó có một nguyên tử nguyên tố oxygen.
Đáp án: B
Giải thích:
Lực hút tĩnh điện giữa các ion mang điện trái dấu trong phân tử (hay tinh thể) tạo ra liên kết ion.
Liên kết ion thường được hình thành giữa kim loại điển hình và phi kim điển hình. Các hợp chất tạo nên từ các ion được gọi là những hợp chất ion.
Câu 6. Hợp chất ion thường được tạo thành từ
A. kim loại điển hình với khí hiếm.
B. hai nguyên tố phi kim điển hình.
C. kim loại điển hình với phi kim điển hình.
D. hai nguyên tố kim loại điển hình.
Đáp án: C
Giải thích:
Kim loại điển hình phản ứng rất mạnh với phi kim điển hình tạo ra hợp chất ion. Khi đó, nguyên tử kim loại nhường electron để tạo thành ion mang điện tích dương (cation) còn nguyên tử phi kim nhận electron để trở thành ion mang điện tích âm (anion).
Câu 7. Phát biểu nào sau đây là đúng?
A. Nguyên tử kim loại nhường electron để tạo thành ion mang điện tích dương (cation).
B. Nguyên tử kim loại nhận electron để tạo thành ion mang điện tích dương (cation).
C. Nguyên tử kim loại nhường electron để tạo thành ion mang điện tích âm (anion).
D. Nguyên tử kim loại nhận electron để tạo thành ion mang điện tích âm (anion).
Đáp án: A
Giải thích:
Nguyên tử kim loại nhường electron để tạo thành ion mang điện tích dương (cation).
Ví dụ:
Cấu hình electron của nguyên tử Na (Z = 11): 1s22s22p63s1
Có 1 electron ở lớp ngoài cùng.
Nguyên tử Na nhường đi 1 electron ở lớp ngoài cùng để tạo thành ion dương Na+ (cation sodium).
Na Na+ + 1e
Câu 8. Phát biểu nào sau đây là đúng?
A. Nguyên tử phi kim nhường electron để tạo thành ion mang điện tích âm (anion).
B. Nguyên tử phi kim nhận electron để tạo thành ion mang điện tích âm (anion).
C. Nguyên tử phi kim nhường electron để tạo thành ion mang điện tích dương (cation).
D. Nguyên tử phi kim nhận electron để tạo thành ion mang điện tích dương (cation).
Đáp án: B
Giải thích:
Nguyên tử phi kim nhận electron để tạo thành ion mang điện tích âm (anion).
Ví dụ: Cấu hình electron của nguyên tử Cl (Z = 17): 1s22s22p63s23p5.
® Có 7 electron ở lớp ngoài cùng.
Nguyên tử Cl nhận 1 electron để tạo thành ion âm Cl- (anion chloride).
Cl + 1e Cl-
Câu 9. Số đơn vị điện tích của ion dương (cation) bằng
A. số electron của nguyên tử ban đầu.
B. số electron mà nguyên tử đã nhường.
C. số lớp electron của nguyên tử.
D. số neutron của nguyên tử.
Đáp án: B
Giải thích:
Số đơn vị điện tích của ion dương (cation) bằng số electron mà nguyên tử đã nhường.
Các ion thường có cấu hình electron bền vững của nguyên tử khí hiếm gần nhất với nguyên tố tạo thành ion đó trong bảng tuần hoàn.
Câu 10. Số đơn vị điện tích của ion âm (anion) bằng
A. số electron mà nguyên tử đã nhận.
B. số electron mà nguyên tử đã nhường.
C. số lớp electron của nguyên tử.
D. số phân lớp electron của nguyên tử.
Đáp án: A
Giải thích:
Số đơn vị điện tích của ion âm (anion) bằng số electron mà nguyên tử đã nhận.
Các ion thường có cấu hình electron bền vững của nguyên tử khí hiếm gần nhất với nguyên tố tạo thành ion đó trong bảng tuần hoàn.
Câu 11. Để tạo thành liên kết hóa học trong phân tử sodium chloride (NaCl):
A. kim loại sodium kết hợp với phi kim chlorine, tạo thành các ion Na+ và Cl-, các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
B. kim loại sodium kết hợp với phi kim chlorine, tạo thành các ion Na- và Cl+, các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
C. kim loại sodium kết hợp với phi kim chlorine, tạo thành các ion Na2+ và Cl-, các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
D. kim loại sodium kết hợp với phi kim chlorine, tạo thành các ion Na+ và Cl2-, các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Đáp án: A
Giải thích:
Xét sự tạo thành liên kết hóa học trong phân tử sodium chloride (NaCl):
Khi kim loại sodium kết hợp với phi kim chlorine, tạo thành các ion Na+ và Cl-, các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Câu 12. Để tạo thành thành liên kết hóa học trong phân tử calcium chloride (CaCl2):
A. kim loại calcium kết hợp với phi kim chlorine, tạo thành các ion Ca+ và Cl-. Các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
B. kim loại calcium kết hợp với phi kim chlorine, tạo thành các ion Ca2+ và Cl-. Các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
C. kim loại calcium kết hợp với phi kim chlorine, tạo thành các ion Ca2- và Cl+. Các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
D. kim loại calcium kết hợp với phi kim chlorine, tạo thành các ion Ca- và Cl+. Các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.
Đáp án: B
Giải thích:
Xét sự thành thành liên kết hóa học trong phân tử calcium chloride (CaCl2):
Khi kim loại calcium kết hợp với phi kim chlorine, tạo thành các ion Ca2+ và Cl-. Các ion này mang điện tích trái dấu sẽ hút nhau tạo thành liên kết ion.

Câu 13. Phát biểu nào sau đây không đúng?
A. Trong tinh thể ion, các ion sắp xếp hỗn độn, không theo một trật tự xác định.
B. Trong tinh thể ion, ở các nút của mạng lưới là những ion dương và ion âm được sắp xếp luân phiên.
C. Trong tinh thể ion, số ion cùng dấu bao quanh một ion trái dấu phụ thuộc vào kiểu mạng lưới tinh thể, số điện tích và kích thước của ion.
D. Trong tinh thể ion, các ion liên kết chặt chẽ với nhau do sự cân bằng giữa lực hút (các ion trái dấu hút nhau) và lực đẩy (các ion cùng dấu đẩy nhau).
Đáp án: A
Giải thích:
Cấu trúc của tinh thể ion:
Các ion được sắp xếp theo một trật tự xác định trong không gian theo kiểu mạng lưới, trong đó ở các nút của mạng lưới là những ion dương và ion âm được sắp xếp luân phiên, liên kết chặt chẽ với nhau do sự cân bằng giữa lực hút (các ion trái dấu hút nhau) và lực đẩy (các ion cùng dấu đẩy nhau), tạo thành mạng tinh thể ion.
Câu 14. Trong tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là
A. chất rắn, dễ nóng chảy, dễ bay hơi ở điều kiện thường.
B. chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường.
C. chất lỏng, khó bay hơi ở điều kiện thường.
D. chất lỏng, dễ bay hơi ở điều kiện thường.
Đáp án: B
Giải thích:
Tron tinh thể ion, giữa các ion có lực hút tĩnh điện rất mạnh nên các hợp chất ion thường là chất rắn, khó nóng chảy, khó bay hơi ở điều kiện thường.
Các tinh thể ion khá rắn chắc, nhưng khá giòn. Đây là tính chất đặc trưng của tinh thể ion.
Câu 15. Phát biểu nào sau đây không đúng?
A. Tinh thể ion khá rắn chắc nhưng khá giòn.
B. Các hợp chất ion thường tan nhiều trong nước.
C. Ở trạng thái rắn, hợp chất ion dẫn điện tốt.
D. Ở trạng thái nóng chảy, hợp chất ion dẫn điện tốt.
Đáp án: C
Giải thích:
Ở trạng thái rắn, các ion không di chuyển tự do được nên hợp chất ion không dẫn điện. Tuy nhiên, ở trạng thái nóng chảy, các ion có thể chuyển động khá tự do nên hợp chất ion dẫn điện.
Bài giảng Hóa học 10 Bài 11: Liên kết ion - Kết nối tri thức
Xem thêm các bài tóm tắt lý thuyết Hóa học 10 Kết nối tri thức hay, chi tiết khác:
Bài 13: Liên kết hydrogen và tương tác van der waals