Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
CHUYÊN ĐỀ 2 : BẢNG TUẦN HOÀN CÁC NGUYÊN TỐ
HÓA HỌC VÀ ĐỊNH LUẬT TUẦN HOÀN
A. TÓM TẮT LÍ THUYẾT
I. Bảng tuần hoàn các nguyên tố hóa học
1. Nguyên tắc sắp xếp :
Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
Các nguyên tố có cùng số lớp electron được xếp thành một hàng.
Các nguyên tố có số electron hóa trị trong nguyên tử như nhau được xếp thành một cột.
● Lưu ý : Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học. Chúng thường nằm ở lớp ngoài cùng hoặc ở cả phân lớp sát lớp ngoài cùng nếu phân lớp đó chưa bão hòa.
2. Cấu tạo của bảng tuần hoàn
a. Ô nguyên tố : Số thứ tự của ô nguyên tố bằng số hiệu nguyên tử, bằng số đơn vị điện tích hạt nhân và bằng tổng số electron của nguyên tử.
b. Chu kì :
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần. Số thứ tự của chu kì bằng số lớp electron của nguyên tử.
Bảng tuần hoàn có 7 chu kì :
Chu kì nhỏ là các chu kì 1, 2, 3 chỉ gồm các nguyên tố s và các nguyên tố p. Mỗi chu kì nhỏ gồm 8 nguyên tố, trừ chu kì 1 chỉ có hai nguyên tố.
Chu kì lớn là các chu kì 4, 5, 6 ,7 gồm các nguyên tố s, p, d và f. Chu kì 4 và chu kì 5 mỗi chu kì có 18 nguyên tố. Chu kì 6 có 32 nguyên tố. Theo quy luật, chu kì 7 cũng phải có 32 nguyên tố, tuy nhiên chu kì 7 mới phát hiện được 24 nguyên tố hóa học. Lí do là các nguyên tố có hạt nhân càng nặng càng kém bền, chúng có “đời sống” rất ngắn ngủi.
c. Nhóm :
Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó tính chất hóa học gần giống nhau và được xếp thành một cột. Nguyên tử các nguyên tố trong cùng một nhóm có số số electron hóa trị bằng nhau và bằng số thứ tự của nhóm (trừ một số trường hợp ngoại lệ).
Bảng tuần hoàn có 18 cột được chia thành 8 nhóm A và 8 nhóm B.
Nhóm A : Gồm 8 nhóm từ IA đến VIIIA, số thứ tự của nhóm bằng số electron hóa trị (số electron ở lớp ngoài cùng), nhóm A gồm các nguyên tố s và p. Nhóm A còn được gọi là các nguyên tố thuộc phân nhóm chính.
Nhóm B : Gồm 8 nhóm từ IB đến VIIIB, số thứ tự của nhóm B bằng số electron hóa trị (số electron lớp ngoài cùng và số electron của phân lớp d sát lớp ngoài nếu phân lớp đó chưa bão hòa), nhóm B gồm các nguyên tố d và f. Nhóm B còn được gọi là các nguyên tố thuộc phân nhóm phụ.
Nguyên tố s, p, d, f là các nguyên tố có các electron ngoài cùng lần lượt điền vào các phân lớp s, p, d, f.
II. Những tính chất biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân
1. Bán kính nguyên tử :
Trong chu kì, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử giảm dần, vì điện tích hạt nhân tăng dần trong khi số lớp electron không thay đổi nên lực hút của hạt nhân với các eletron tăng dần, khoảng cách từ hạt nhân đến các eletron ngoài cùng giảm dần, dẫn đến bán kính giảm dần.
Trong nhóm A, theo chiều tăng của điện tích hạt nhân, bán kính nguyên tử tăng dần, do số lớp electron tăng dần.
2. Năng lượng ion hoá (I) :
Trong chu kì, theo chiều tăng của điện tích hạt nhân, năng lượng ion hóa của nguyên tử tăng dần, vì điện tích hạt nhân tăng dần trong khi số lớp electron không thay đổi nên lực hút của hạt nhân với các eletron tăng dần, dẫn đến năng lượng cần dùng để tách eletron ra khỏi nguyên tử tăng dần.
Trong nhóm A, theo chiều tăng của điện tích hạt nhân, năng lượng ion hóa của nguyên tử giảm dần vì electron ở xa hạt nhân hơn, liên kết với hạt nhân yếu hơn, dễ bị tách ra khỏi nguyên tử hơn.3. Độ âm điện (: campa) : Độ âm điện là một khái niệm mang tính chất kinh nghiệm và thay đổi theo thang đo và chỉ có ý nghĩa tương đối. Độ âm điện đặc trưng cho khả năng hút electron về phía mình của nguyên tử trong phân tử.
Trong chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện của nguyên tử tăng dần.
Trong nhóm A, theo chiều tăng của điện tích hạt nhân, độ âm điện của nguyên tử giảm dần.
4. Tính kim loại - phi kim :
Trong chu kì, theo chiều tăng của điện tích hạt nhân, tính kim loại giảm dần và tính phi
kim tăng dần.
Trong nhóm A, theo chiều tăng của điện tích hạt nhân, tính kim loại tăng dần và tính phi
kim giảm dần.
5. Sự biến đổi về hóa trị của các nguyên tố
Trong một chu kì, theo chiều tăng của điện tích hạt nhân, số electron lớp ngoài cùng tăng dần từ 1 đến 8, hóa trị cao nhất của các nguyên tố đối với oxi tăng dần từ 1 đến 7, còn hóa trị với hiđro của các phi kim giảm từ 4 đến 1.
6. Tính axit - bazơ của oxit và hiđroxit : Trong một chu kì, theo chiều tăng của điện tích hạt nhân, tính bazơ của các oxit và hiđroxit tương ứng yếu dần, đồng thời tính axit của chúng mạnh dần.
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính bazơ của các oxit và hiđroxit tương ứng mạnh dần, đồng thời tính axit của chúng yếu dần.
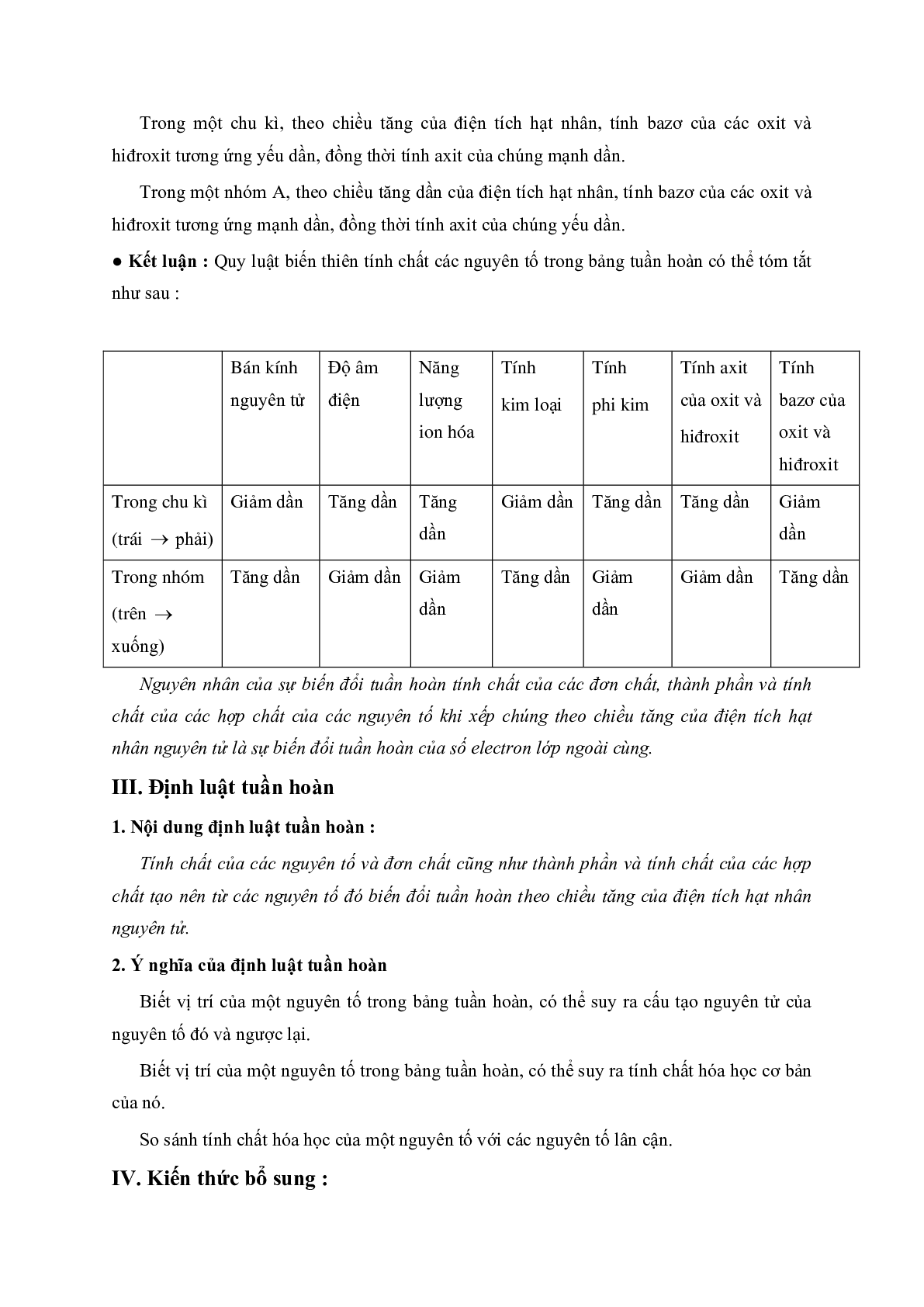
● Kết luận : Quy luật biến thiên tính chất các nguyên tố trong bảng tuần hoàn có thể tóm tắt như sau :
Nguyên nhân của sự biến đổi tuần hoàn tính chất của các đơn chất, thành phần và tính chất của các hợp chất của các nguyên tố khi xếp chúng theo chiều tăng của điện tích hạt nhân nguyên tử là sự biến đổi tuần hoàn của số electron lớp ngoài cùng.
III. Định luật tuần hoàn
1. Nội dung định luật tuần hoàn :
Tính chất của các nguyên tố và đơn chất cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử.
2. Ý nghĩa của định luật tuần hoàn
Biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra cấu tạo nguyên tử của nguyên tố đó và ngược lại.
Biết vị trí của một nguyên tố trong bảng tuần hoàn, có thể suy ra tính chất hóa học cơ bản của nó.
So sánh tính chất hóa học của một nguyên tố với các nguyên tố lân cận.
IV. Kiến thức bổ sung :
1. Xác định vị trí nguyên tố trong bảng hệ thống tuần hoàn:
2. E hóa trị : Là các electron tham gia vào sự tạo thành liên kết hóa học.