Những phát biểu nào sau đây là đúng?
(a) Orbital 1s có dạng hình cầu, orbital 2s có dạng hình số tám nổi.
(b) Trong một nguyên tử, năng lượng của electron thuộc AO 1s thấp hơn năng lượng của electron thuộc AO 2s.
(c) Trong một nguyên tử*, năng lượng của electron thuộc AO 2s thấp hơn năng lượng của electron thuộc AO 2p.
(d) Trong một nguyên tử, năng lượng của electron thuộc AO 2s gần năng lượng của electron thuộc AO 2p.
(*) Ngoại trừ nguyên tử H có năng lượng các phân lớp trong một lớp là bằng nhau.
 Giải bởi Vietjack
Giải bởi Vietjack
(a) Sai. Cả orbital 1s và 2s đều có dạng hình cầu. Sự khác biệt giữa chúng nằm ở kích thước và số lượng mặt sóng. Orbital 2s có kích thước lớn hơn và có một mặt sóng bổ sung so với orbital 1s.
(b) Đúng. Theo quy tắc Aufbau, electron luôn điền vào các orbital có mức năng lượng thấp trước. Electron thuộc các lớp khác nhau, càng xa hạt nhân thì có năng lượng càng cao. Do đó, orbital 1s có năng lượng thấp hơn orbital 2s.
(c) Sai. Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
(d) Đúng. Năng lượng của electron thuộc AO 2s và 2p khá gần nhau, đặc biệt là trong các nguyên tử nhẹ. Tuy nhiên, như đã nói ở trên, trong hầu hết các trường hợp, năng lượng của orbital 2s vẫn thấp hơn một chút so với orbital 2p. Nhưng nhìn chung, các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
Cấu hình electron của các ion được thiết lập bằng cách nhận hoặc nhường electron, bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng.
a) Viết cấu hình electron của ion Na+ và ion Cl-.
b) Nguyên tử Cl nhận 1 electron để trở thành ion Cl-, electron này xếp vào AO thuộc phân lớp nào của Cl? AO đó là AO trống, chứa 1 hay 2 electron?
Biểu diễn cấu hình theo orbital (chỉ với lớp ngoài cùng) các nguyên tử có Z từ 1 đến 20. Xác định số electron độc thân của mỗi nguyên tử.
Lớp electron thứ tư (n = 4) có bao nhiêu phân lớp và kí hiệu các phân lớp này là gì?
Nguyên tử nguyên tố X có hai lớp electron, trong đó có một electron độc thân. Vậy X có thể là những nguyên tố nào?
Lớp ngoài cùng của nitrogen (Z = 7) có bao nhiêu electron, bao nhiêu AO?
Cho biết sự phân bố electron theo lớp của các nguyên tử H, He, Li như sau:
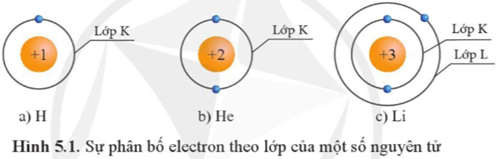
Dựa vào hình 5.1, hãy cho biết số electron tối đa ở lớp K của các nguyên tử có số hiệu nguyên tử Z ≥ 2 là bao nhiêu. Theo em, thứ tự phân bố electron vào lớp vỏ nguyên tử như thế nào?
Tính số electron tối đa (bão hòa) trên mỗi phân lớp ns, np, nd, nf
Vì sao số AO trong một lớp luôn bằng một nửa số electron tối đa thuộc lớp đó?
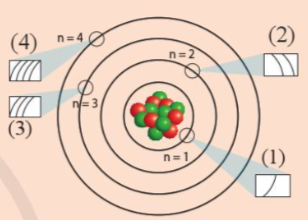
Các ô (1), (2), (3), (4) trong hình dưới đây liên hệ với nội dung nào về cấu tạo lớp vỏ nguyên tử?
Viết cấu hình electron của các nguyên tố có số hiệu nguyên tử từ 1 đến 20