Kim loại M có số hiệu nguyên tử là 25. Vị trí của M trong bảng tuần hoàn là
A. nhóm VIIA, chu kỳ 4
B. nhóm VIIB, chu kỳ 4
C. nhóm VB, chu kỳ 4
D. nhóm VA, chu kì 4
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án B
► Cấu hình electron của M: 1s22s22p63s23p63d54s2.
– Electron cuối cùng điền vào phân lớp d ⇒ thuộc phân nhóm B.
– Lớp ngoài cùng là lớp N (n = 4) ⇒ thuộc chu kì 4.
– Electron hóa trị = 5 + 2 = 7 ⇒ thuộc nhóm VII
Cấu hình electron của nguyên tử
Cấu hình electron của nguyên tử biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp khác nhau.
Nguyên lí vững bền: Các electron trong nguyên tử ở trạng thái cơ bản lần lượt chiếm các orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s …
Quy tắc Hund (Hun): Trong cùng một phân lớp, các electron sẽ phân bố trên các orbital sao cho số electron độc thân là tối đa và các electron này có chiều tự quay giống nhau.
Cấu hình electron của nguyên tử cho biết số lớp electron, thứ tự phân lớp electron và số electron trong mỗi lớp và mỗi phân lớp.
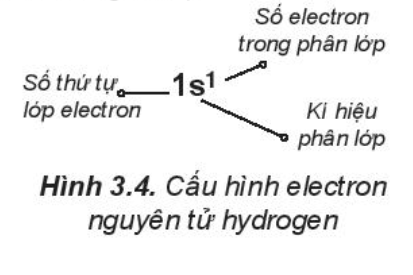
1. Viết cấu hình electron của nguyên tử
Bước 1: Xác định số electron trong nguyên tử.
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng của năng lượng: 1s 2s 2p 3s 3p 4s …
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng.
Ví dụ 1: Viết cấu hình electron của nguyên tử nitrogen (Z = 7).
- Tổng số electron của nguyên tử N là 7.
- Viết thứ tự các lớp và phân lớp electron: 1s22s22p3.
- Có thể thay 1s2 bằng kí hiệu [He]. Cấu hình electron của nguyên tử N là 1s22s22p3 hoặc [He]2s22p3 hoặc (2, 5).
Electron cuối cùng điền vào phân lớp p nên nitrogen là nguyên tố p.
Ví dụ 2: Viết cấu hình electron của nguyên tử potassium (Z = 19).
- Tổng số electron của nguyên tử K là 19.
- Viết thứ tự các lớp và phân lớp electron: 1s22s22p63s23p64s1.
- Có thể thay 1s22s22p63s23p6 bằng kí hiệu [Ar]. Cấu hình electron của nguyên tử K là 1s22s22p63s23p64s1 hoặc [Ar]4s1 hoặc (2, 8, 8, 1).
Electron cuối cùng điền vào phân lớp s nên potassium là nguyên tố s.
2. Biểu diễn cấu hình electron theo ô orbital
Ví dụ: Cấu hình electron của nguyên tử nitrogen có Z = 7: 1s22s22p5 có thể được biểu diễn theo ô orbital như sau:
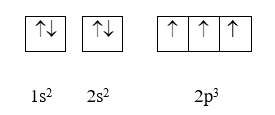
Hai ô orbital 1s và 2s có đủ 2 electron được biểu diễn bằng hai mũi tên ngược chiều nhau (nguyên lí Pauli). 3 electron còn lại được sắp xếp vào 3 orbital 2p bằng 3 mũi tên đi lên để số electron độc thân là tối đa (quy tắc Hund).
3. Đặc điểm của lớp electron ngoài cùng
Dựa vào đặc điểm về cấu hình electron lớp ngoài cùng để dự đoán tính chất hóa học cơ bản của nguyên tố:
- Nguyên tố mà nguyên tử đủ 8 electron lớp ngoài cùng là khí hiếm (trừ He).
- Nguyên tố mà nguyên tử có 1, 2, 3 electron lớp ngoài cùng thường là nguyên tố kim loại.
- Các nguyên tố mà nguyên tử có 4 electron lớp ngoài cùng có thể là kim loại hoặc phi kim.
- Nguyên tố mà nguyên tử có 5, 6, 7 electron lớp ngoài cùng thường là nguyên tố phi kim.
Xem thêm một số kiến thức liên quan:
20 câu Trắc nghiệm Mở đầu (Kết nối tri thức) có đáp án – Hóa học lớp 10
Lý thuyết Thành phần của nguyên tử (Kết nối tri thức) hay, chi tiết | Hóa học 10
Đun nóng chất X với dung dịch NaOH đun nóng thu được dung dịch Y chứa hai muối. Chất X là
đủ vCho 8,3 gam hỗn hợp Fe và Al phản ứng vừaới dung dịch H2SO4 20% thu được dung dịch A và 5,6 lít (đktc). Khối lượng dung dịch A là
Chất X có công thức C5H10O2, đun nóng X với dung dịch NaOH thu được ancol có phân tử khối bằng 32. Số công thức cấu tạo của X là
Chất nào sau đây vừa phản ứng với dung dịch NaOH vừa làm mất màu dung dịch brom?
Chất X có công thức C3H9O2N, phản ứng với dung dịch NaOH đun nóng thu được khí làm xanh quỳ ẩm, có tỷ khối so với H2 nhỏ hơn 16. Số công thức cấu tạo có thể có của X là
Đun nóng 8,76 gam Gly–Ala với 300 ml dung dịch NaOH 1M thu được dung dịch X. Cho dung dịch X phản ứng vừa đủ với dung dịch H2SO4 loãng dư thu được dung dịch chứa m gam muối. Giá trị của m là
Thủy phân hoàn toàn 200 gam hỗn hợp tơ tằm và lông cừu thu được 31,7 gam glyxin. Biết thành phần phần trăm về khối lượng của glyxin trong tơ tằm và lông cừu lần lượt là 43,6% và 6,6%. Thành phần phần trăm về khối lượng tơ tằm trong hỗn hợp kể trên là








Bình “ga” loại 12 cân sử dụng trong hộ gia đình có chứa 12 kg khí hóa lỏng (LPG) gồm propan và butan với tỉ lệ mol tương ứng là 1 : 2. Khi được đốt cháy hoàn toàn, 1 mol propan tỏa ra lượng nhiệt là 2220 kJ và 1 mol butan tỏa ra lượng nhiệt là 2874 kJ. Trung bình mỗi ngày, một hộ gia đình cần đốt gas để cung cấp 9960 kJ nhiệt (có 20% nhiệt đốt cháy bị thất thoát ra ngoài môi trường). Sau bao nhiêu ngày hộ gia đình trên sẽ sử dụng hết bình gas 12 kg?


