Hằng số tốc độ phản ứng k bằng vận tốc tức thời 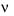 khi
khi
A. nồng độ chất phản ứng bằng đơn vị (1 M);
B. nhiệt độ ở 0°C;
C. nhiệt độ ở 25°C;
D. Hằng số tốc độ phản ứng k không thể bằng vận tốc tức thời 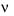 .
.
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: A
Hằng số tốc độ phản ứng k bằng vận tốc tức thời 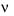 khi nồng độ chất phản ứng bằng đơn vị (1 M), khi đó k là tốc độ phản ứng và được gọi là tốc độ riêng.
khi nồng độ chất phản ứng bằng đơn vị (1 M), khi đó k là tốc độ phản ứng và được gọi là tốc độ riêng.
- Hằng số tốc độ phản ứng k là một hằng số đặc trưng cho mỗi phản ứng, không phụ thuộc vào nồng độ của chất phản ứng. Nó cho biết tốc độ của phản ứng khi nồng độ các chất phản ứng bằng một giá trị nhất định.
- Vận tốc tức thời là tốc độ của phản ứng tại một thời điểm cụ thể và phụ thuộc vào nồng độ của các chất phản ứng tại thời điểm đó.
Giá trị của k: Cho biết phản ứng xảy ra nhanh hay chậm. Giá trị k càng lớn, phản ứng diễn ra càng nhanh.
Điều kiện để k = v: Điều kiện này chỉ đúng khi nồng độ các chất phản ứng đều bằng 1. Trong thực tế, nồng độ các chất phản ứng thường thay đổi theo thời gian, do đó vận tốc tức thời cũng thay đổi.
Cho phản ứng đơn giản xảy ra trong bình kín: 3H2(g) + N2 (g) ⟶ 2NH3 (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 và N2 đều tăng 3 lần.
Cho phản ứng đơn giản xảy ra trong bình kín: 2CO (g) + O2 (g) ⟶ 2CO2 (g).
Tốc độ phản ứng thay đổi như thế nào nếu tăng nồng độ CO gấp 2 lần, nồng độ O2 không đổi.
Biểu thức tốc độ trung bình của phản ứng: aA + bB ⟶ cC + dD là
Cho phản ứng đơn giản xảy ra trong bình kín: H2(g) + Cl2 (g) ⟶ 2HCl (g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ H2 giảm 4 lần và nồng độ Cl2 tăng 2 lần.
Cho phản ứng: 2H2O2 (aq) O2 (s) +2H2O (l)
O2 (s) +2H2O (l)
Cho chất xúc tác MnO2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 33,6 ml khí O2 (ở đktc). Tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây trên là
Cho phản ứng:
2N2O5 (g) ⟶ O2 (g) + 4NO2 (g)
Sau thời gian từ giây 57 đến giây 116, nồng độ N2O5 giảm từ 0,4 M về 0,35 M. Tốc độ trung bình của phản ứng trong khoảng thời gian trên là
Cho phản ứng đơn giản có dạng: aA + bB ⟶ cC + dD
Mối quan hệ giữa nồng độ và tốc độ tức thời của phản ứng hóa học được biểu diễn bằng biểu thức
Cho phản ứng ở 45°C
2N2O5 (g) ⟶ O2 (g) + 2N2O4 (g)
Sau 275 giây đầu tiên, nồng độ của O2 là 0,188 M. Tính tốc độ trung bình của phản ứng theo O2 trong khoảng thời gian trên.
Cho phản ứng: 2SO2 (g) + O2 (g) 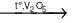 2SO3 (g)
2SO3 (g)
Biểu thức tốc độ thức thời của phản ứng theo định luật tác dụng khối lượng là
Cho phản ứng: Br2 (l) + HCOOH (aq) 2HBr (aq) + CO2 (s)
Nồng độ ban đầu của Br2 là aM, sau 50 giây nồng độ Br2 còn lại là 0,02M. Tốc độ trung bình của phản ứng trên là 4.10-5M/s. Giá trị của a là