Cho phản ứng: 2CO (g) + O2 (g) ⟶ 2CO2 (g)
Với hệ số nhiệt độ Van’t Hoff 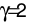 . Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ phản ứng từ 40°C lên 70°C?
. Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ phản ứng từ 40°C lên 70°C?
A. tăng gấp 2 lần;
B. tăng gấp 8 lần;
C. giảm 4 lần;
D. tăng gấp 6 lần.
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: B
Ta có:  =
= 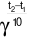 ⇒
⇒ =
= 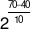 = 23 = 8
= 23 = 8
⇒ Tốc độ phản ứng tăng gấp 8 lần.
Mở rộng kiến thức về tốc độ phản ứng:
1. Khái niệm tốc độ phản ứng hóa học
- Tốc độ phản ứng của một phản ứng hóa học là đại lượng đặc trưng cho sự thay đổi nồng độ của chất phản ứng hoặc sản phẩm phản ứng trong một đơn vị thời gian: giây (s), phút (min), giờ (h), ngày (d), …
- Tốc độ phản ứng kí hiệu là v, đơn vị tốc độ phản ứng là (đơn vị nồng độ) (đơn vị thời gian)-1, ví dụ: mol L-1 s-1 hay M s-1.
- Các phản ứng khác nhau xảy ra với tốc độ khác nhau:
2. Tốc độ trung bình của phản ứng
- Đa số các phản ứng có tốc độ giảm dần theo thời gian, để đặc trưng cho sự nhanh chậm của phản ứng trong một khoảng thời gian, ta dùng tốc độ phản ứng trung bình.
Như vậy: Tốc độ trung bình của phản ứng () là tốc độ tính trung bình trong một khoảng thời gian phản ứng.
- Cho phản ứng tổng quát: aA + bB dD + eE
Tốc độ phản ứng được tính dựa theo thay đổi nồng độ của một chất bất kì trong phản ứng theo quy ước sau:
.
Trong đó: CA; CB; CD; CE lần lượt là biến thiên lượng các chất A, B, D, E trong khoảng thời gian Dt.
- Ví dụ: Cho phản ứng phân hủy N2O5:
2N2O5(g) 4NO2(g) + O2(g).
Tính tốc độ trung bình của phản ứng. Biết nồng độ của mỗi chất trong phản ứng trên tại thời điểm t1 = 0 và t2 = 100 s như sau:
Hướng dẫn:
Cách 1: Tính theo N2O5.
(M.s-1)
Cách 2: Tính theo NO2.
(M.s-1)
- Chú ý: Sự thay đổi lượng chất trong khoảng thời gian vô cùng ngắn được gọi là tốc độ tức thời của phản ứng.
II. Các yếu tố ảnh hưởng đến tốc độ phản ứng
1. Ảnh hưởng của nồng độ đến tốc độ phản ứng
- Thông thường, khi nồng độ tăng, tốc độ phản ứng sẽ tăng.
- Giải thích:
+ Trong quá trình phản ứng, các hạt (phân tử, nguyên tử hoặc ion) luôn chuyển động không ngừng và va chạm với nhau. Những va chạm có năng lượng đủ lớn phá vỡ liên kết cũ, hình thành liên kết mới dẫn tới phản ứng hóa học được gọi là va chạm hiệu quả.
+ Khi nồng độ các chất phản ứng tăng lên, số va chạm giữa các hạt tăng lên, làm số va chạm hiệu quả cũng tăng lên và dẫn tới tốc độ phản ứng tăng.
2. Ảnh hưởng của áp suất đến tốc độ phản ứng
- Trong hỗn hợp khí, nồng độ mỗi khí tỉ lệ thuận với áp suất của nó. Khi nén hỗn hợp khí (giảm thể tích) thì nồng độ mỗi khí tăng lên. Việc tăng áp suất hỗn hợp khí cũng tương tự như tăng nồng độ, sẽ làm tốc độ phản ứng tăng.
- Việc thay đổi áp suất không làm ảnh hưởng đến tốc độ của phản ứng không có chất khí tham gia.
3. Ảnh hưởng của nhiệt độ đến tốc độ phản ứng
- Khi tăng nhiệt độ, các hạt (phân tử, nguyên tử hoặc ion) sẽ chuyển động nhanh hơn, động năng cao hơn. Khi đó, số va chạm hiệu quả giữa các hạt tăng lên, dẫn đến tốc độ phản ứng tăng.
- Nhiệt độ càng cao, tốc độ phản ứng càng lớn. Với đa số các phản ứng, khi nhiệt độ tăng lên 10oC thì tốc độ phản ứng tăng từ 2 đến 4 lần. Giá trị g = 2 – 4 này gọi là hệ số nhiệt độ Van’t Hoff.
- Mối liên hệ của hệ số Van’t Hoff với tốc độ và nhiệt độ như sau:
Trong đó, v2 và v1 là tốc độ phản ứng ở nhiệt độ T2 và T1 tương ứng.
4. Ảnh hưởng của diện tích bề mặt đến tốc độ phản ứng
- Khi tăng diện tích bề mặt tiếp xúc, số va chạm giữa các chất đầu tăng lên, số va chạm hiệu quả cũng tăng theo, dẫn đến tốc độ phản ứng tăng.
- Chú ý:
+ Nếu kích thước hạt càng nhỏ thì tổng diện tích bề mặt càng lớn, nên có thể tăng diện tích tiếp xúc bằng cách đập nhỏ hạt.
+ Ngoài ra, có thể tăng diện tích bề mặt của một khối bằng cách tạo nhiều đường rãnh, lỗ xốp trong lòng khối chất đó. Khi đó, diện tích bề mặt bao gồm diện tích bề mặt trong và diện tích bề mặt ngoài.
5. Ảnh hưởng của chất xúc tác đến tốc độ phản ứng
- Khi có xúc tác, phản ứng sẽ xảy ra qua nhiều giai đoạn. Mỗi giai đoạn đều có năng lượng hoạt hóa thấp hơn so với phản ứng không xúc tác. Do đó, số hạt có đủ, năng lượng hoạt hóa sẽ nhiều hơn, dẫn đến tốc độ phản ứng tăng lên.
- Chú ý:
+ Năng lượng hoạt hóa là năng lượng tối thiểu cần cung cấp cho các hạt (nguyên tử, phân tử hoặc ion) để va chạm giữa chúng gây ra phản ứng hóa học.
+ Sau phản ứng, khối lượng và bản chất của chất xúc tác không đổi, tuy nhiên, kích thước, hình dạng hạt, độ xốp, … có thể thay đổi.
III. Một số ứng dụng của việc thay đổi tốc độ phản ứng
- Trong đời sống và sản xuất, con người áp dụng nhiều biện pháp kĩ thuật để thay đổi tốc độ phản ứng như thay đổi nồng độ, nhiệt độ, dùng chất xúc tác, …
Hệ số nhiệt độ Van’t Hoff của một phản ứng là 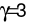 . Tốc độ phản ứng thay đổi như thế nào khi giảm nhiệt độ phản ứng từ 80°C về 60°C?
. Tốc độ phản ứng thay đổi như thế nào khi giảm nhiệt độ phản ứng từ 80°C về 60°C?
Thí nghiệm cho 7 gam kẽm hạt vào một cốc đựng dung dịch H2SO4 3M ở nhiệt độ thường. Tác động nào sau đây không làm tăng tốc độ của phản ứng?
Khi đốt than trong lò, đậy nắp lò sẽ giữ than cháy được lâu hơn.
Yếu tố ảnh hưởng đến tốc độ phản ứng được vận dụng trong ví dụ trên là
Cho hiện tượng sau: Tàn đóm đỏ bùng lên khi cho vào bình oxygen nguyên chất.
Hiện tượng trên thể hiện ảnh hưởng của yếu tố nào đến tốc độ phản ứng?
Người ta sử dụng phương pháp nào để tăng tốc độ phản ứng trong trường hợp sau: Nén hỗn hợp khí N2 và H2 ở áp suất cao để tổng hợp NH3.
Mối quan hệ giữa nhiệt độ và tốc độ phản ứng hóa học được biểu diễn bằng công thức
Người ta vận dụng yếu tố nào để tăng tốc độ phản ứng trong trường hợp sau: Nung hỗn hợp bột đá vôi, đất sét và thạch cao ở nhiệt độ cao để sản xuất clinke trong công nghiệp sản xuất xi măng.
Chất làm tăng tốc độ phản ứng hóa học, nhưng vẫn được bảo toàn về chất và lượng khi kết thúc phản ứng là
Cho phản ứng sau: 2KMnO4 (s) → K2MnO4 (s) + MnO2 (s) + O2 (g). Yếu tố không ảnh hưởng đến tốc độ của phản ứng này là:
Hiện tượng nào dưới đây thể hiện ảnh hưởng của nhiệt độ đến tốc độ phản ứng?