Cho hai phản ứng có phương trình hóa học như sau:
2O3 (g) → 3O2 (g) (1)
2HOF (g) → 2HF (g) + O2 (g) (2)
a) Viết biểu thức tốc độ trung bình (theo cả các chất phản ứng và chất sản phẩm) của hai phản ứng trên.
 Giải bởi Vietjack
Giải bởi Vietjack
a) Phản ứng (1):
Phản ứng (2):
Cho phản ứng đơn giản:
H2 + I2 → 2HI
Người ta thực hiện ba thí nghiệm với nồng độ các chất đầu (và ) được lấy khác nhau và xác định được tốc độ tạo thành HI trong 20 giây đầu tiên, kết quả cho trong bảng sau:
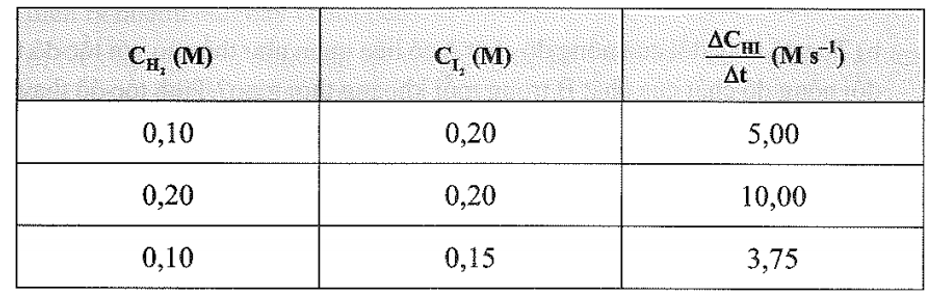
Biểu thức định luật tác dụng viết cho phản ứng trên là:
Từ một miếng đá vôi và một lọ dung dịch HCl 1 M, thí nghiệm được tiến hành trong điều kiện nào sau đây sẽ thu được lượng CO2 lớn nhất trong một khoảng thời gian xác định?
Enzyme catalase phân huỷ hydrogen peroxide thành oxygen và nước nhanh gấp khoảng 107 lần sự phân huỷ khi không có xúc tác. Giả sử một phản ứng không có xúc tác phân huỷ một lượng hydrogen peroxide mất 360 ngày, hãy tính thời gian (theo giây) cho sự phân huỷ cùng một lượng hydrogen peroxide đó khi sử dụng enzyme catalase làm xúc tác.
Một bạn học sinh thực hiện hai thí nghiệm:
Thí nghiệm 1: Cho 100 mL dung dịch acid HCl vào cốc (1), sau đó thêm một mẫu kẽm và đo tốc độ khí H2 thoát ra theo thời gian.
Thí nghiệm 2 (lặp lại tương tự thí nghiệm 1): 100 mL dung dịch acid HCl khác được cho vào cốc (2) rồi cũng thêm một mẫu kẽm vào và lại đo tốc độ khí hydrogen thoát ra theo thời gian.
Bạn học sinh đó nhận thấy tốc độ thoát khí hydrogen ở cốc (2) nhanh hơn ở cốc (1).
Những yếu tố nào sau đây có thể dùng để giải thích hiện tượng mà bạn đó quan sát được?
A. Phản ứng ở cốc (2) nhanh hơn nhờ có chất xúc tác.
B. Lượng kẽm ở cốc (1) nhiều hơn ở cốc (2).
C. Acid HCl ở cốc (1) có nồng độ thấp hơn acid ở cốc (2).
D. Kẽm ở cốc (2) được nghiền nhỏ còn kẽm ở cốc (1) ở dạng viên.
Cho phản ứng:
6CH2O + 4NH3 → (CH2)6N4 + 6H2O
Tốc độ trung bình của phản ứng trên được biểu diễn bằng những biểu thức nào trong những biểu thức sau?
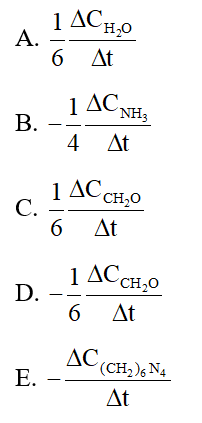
Phản ứng 3H2 + N2 → 2NH3 có tốc độ mất đi của H2 so với tốc độ hình thành NH3 như thế nào?
Khi nghiên cứu ảnh hưởng của nhiệt độ tới tốc độ của phản ứng giữa Mg(s) với HCl(aq), những mô tả nào sau đây phản ánh đúng hiện tượng quan sát được khi làm thí nghiệm?
A. Khi đun nóng, bọt khí thoát ra nhanh hơn so với không đun nóng.
B. Khi đun nóng, bọt khí thoát ra chậm hơn so với không đun nóng.
C. Khi đun nóng, dây Mg tan nhanh hơn so với không đun nóng.
D. Khi đun nóng, dây Mg tan chậm hơn so với không đun nóng.
Khi cho một lượng xác định chất phản ứng vào bình để cho phản ứng hoá học xảy ra, tốc độ phản ứng sẽ
Những phát biểu nào sau đây là đúng?
A. Tốc độ của phản ứng hoá học là đại lượng mô tả mức độ nhanh hay chậm của chất phản ứng được sử dụng hoặc sản phẩm được tạo thành.
B. Tốc độ của phản ứng hoá học là hiệu số nồng độ của một chất trong hỗn hợp phản ứng tại hai thời điểm khác nhau.
C. Tốc độ của phản ứng hoá học có thể có giá trị âm hoặc dương.
D. Trong cùng một phản ứng hoá học, tốc độ tạo thành của các chất sản phẩm khác nhau là khác nhau, tuỳ thuộc vào hệ số cân bằng của chúng trong phương trình hoá học.
E. Trong cùng một phản ứng hoá học, tốc độ tiêu thụ các chất phản ứng khác nhau sẽ như nhau nếu chúng được lấy với cùng một nồng độ.
Phản ứng A → 2B được thực hiện trong một bình phản ứng. Số liệu thực nghiệm của phản ứng được cho trong bảng sau:

a) Hãy tính sự thay đổi nồng độ chất B sau mỗi 10 giây từ 0,0 tới 40,0 giây. Các giá trị này tăng hay giảm khi đi từ khoảng thời gian này sang khoảng thời gian tiếp theo? Vì sao?
Tốc độ phản ứng còn được tính theo sự thay đổi lượng chất (số mol, khối lượng) theo thời gian. Cho hai phản ứng xảy ra đồng thời trong hai bình (1) và (2):
Ca + Cl2 → CaCl2 (1)
2K + Cl2 → 2KCl (2)
Sau 2 phút, có 3 gam CaCl2 được hình thành theo phản ứng (1).
a) Xác định tốc độ trung bình của phản ứng (theo đơn vị mol phút -1) theo lượng sản phẩm được tạo ra.