Tailieumoi.vn giới thiệu Giải bài tập hóa học 8 Bài 20: Tỉ khối và chất khí, chi tiết nhất giúp học sinh dễ dàng làm bài tập Tỉ khối và chất khí lớp 8.
Hãy cho biết :
a) Những khí nào nặng hay nhẹ hơn khí hiđro và nặng hay nhẹ hơn bằng bao nhiêu lần.
b) Những khí nào nặng hay nhẹ hơn không khí và nặng hay nhẹ hơn bao nhiêu lần.
Lời giải:
a) Trong số các chất khí, khí hiđro nhẹ nhất. Tỉ khối của các khí đối với hiđro:
= = = 14, Vậy khí N2 nặng hơn khí H2 14 lần;
= = = 16, Vậy O2 nặng hơn khí H2 16 lần;
= = = 35,5, Vậy khí Cl2 nặng hơn khí H2 35,5 lần;
= = = 14, Vậy khí CO nặng hơn khí H2 14 lần;
= = = 32, Vậy khí SO2 nặng hơn khí H2 32 lần;
b) Tỉ khối của các khí đối với không khí:
= = ≈ 0,966, vậy khí N2; nhẹ hơn không khí 0,966 lần;
= = ≈ 1,103, vậy khí O2 nặng hơn không khí 1,103 lần;
= = ≈ 2,448, vậy khí Cl2 nặng hơn không khí 2,448 lần;
= = ≈ 0,966, vậy khí CO nhẹ hơn không khí 0,966 lần;
= = ≈ 2,207, vậy khí SO2 nặng hơn không khí 2,207 lần.
a) Có tỉ khối đối với oxi là: 1,375; 0,0625
b) Có tỉ khối đối với không khí là: 2,207; 1,172
Lời giải:a) Đặt đứng bình ?
b) Đặt ngược bình ?
Giải thích việc làm này.
Lời giải:- Những khí nặng hơn không khí có thể thu được bằng cách đặt đứng bình.
- Những khí nhẹ hơn không khí có thể thu được bằng cách đặt ngược bình.
Ta có tỉ khối của các khí so với không khí:
= = = 0,07;
= = = 2,45
= = = 1,52;
= = = 0,55
a) Khi đặt đứng bình ta sẽ thu được những chất khí nặng hơn không khí (có tỉ khối đối với không khí lớn hơn 1) như khí clo (nặng hơn 2,45 lần), khí cacbon đioxit (1,52 lần).
b) Khi đặt ngược bình ta sẽ thu được những chất nhẹ hơn không khí (có tỉ khối đối với không khí nhỏ hơn 1) như khí hiđro (nhẹ hơn 0,07 lần), khí metan (nhẹ hơn 0,55 lần).
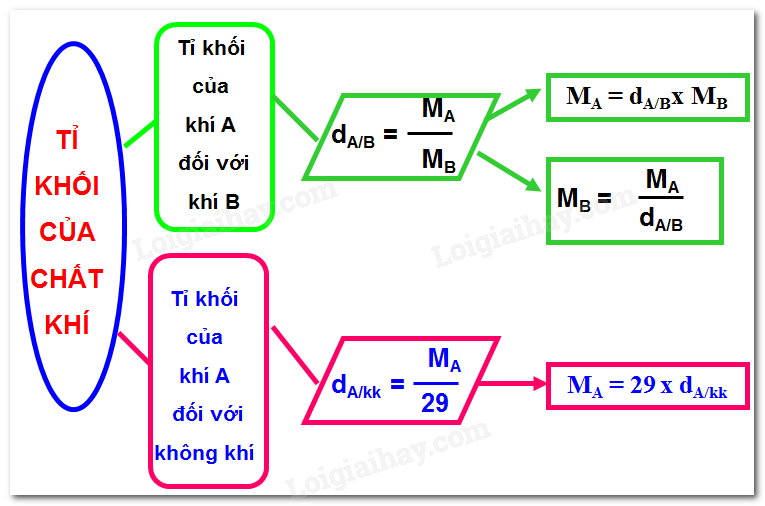
I. Công thức tính tỉ khối
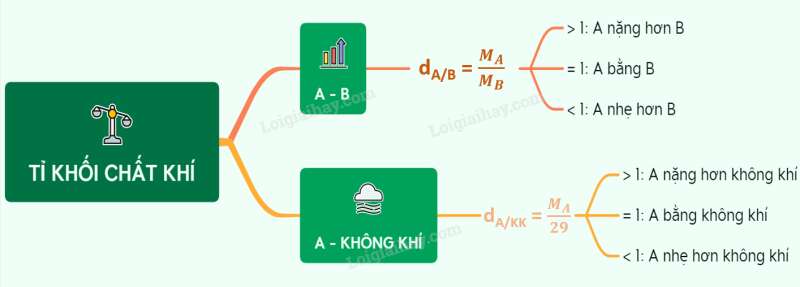
- Để so sánh khí A nặng hơn hay nhẹ hơn khí B, người ta dựa vào tỉ khối của chất khí (tỉ khối là tỉ số khối lượng mol của 2 chất khí)
- Kí hiệu: dA/B
- Công thức:
Trong đó: dA/B là tỉ khối của khí A đối với khí B
MA : khối lượng mol của khí A
MB : khối lượng mol của khí B
- Nếu dA/B > 1 => khí A nặng hơn khí B
- Nếu dA/B = 1 => khí A nặng bằng khí B
- Nếu dA/B < 1 => khí A nhẹ hơn khí B
Ví dụ: Khí cacbonic (CO2) nặng hay nhẹ hơn khí hiđro (H2)?
Lời giải:
Khối lượng mol của khí CO2 là:
Khối lượng mol của khí H2 là:
Ta có : > 1 => Khí cacbonic nặng hơn khí hiđro gấp 22 lần.
II. Tỉ khối của khí A so với không khí
- Trong sinh học chúng ta đã biết không khí là hỗn hợp gồm nhiều khí, trong đó có hai khí chính là khí N2 chiếm khoảng 80% và khí O2 chiếm khoảng 20%. Do đó, khối lượng của “mol không khí” là khối lượng của 0,8 mol khí nitơ + khối lượng 0,2 mol khí oxi
=> Mkhông khí = 0,8.28 + 0,2.32 = 28,8 ≈ 29 gam
* Công thức tỉ khối của khí A so với không khí:
Trong đó: dA/kk : tỉ khối của khí A đối với không khí
MA : khối lượng mol của khí A
Mkk : khối lượng mol của không khí
Ví dụ: Khí cacbonic (CO2) nặng hay nhẹ hơn khí hiđro (H2)?
Lời giải:
Khối lượng mol của khí CO2 là:
Khối lượng mol của khí H2 là:
Ta có : > 1 => Khí cacbonic nặng hơn khí hiđro gấp 22 lần.
Ví dụ: Khí cacbonic (CO2) nặng hay nhẹ hơn không khí bao nhiêu lần?
Lời giải:
Khối lượng mol của khí CO2 là:
Ta có : > 1 => khí CO2 nặng hơn không khí 1,52 lần
III. Tỉ khối của hỗn hợp khí
Xét hỗn hợp khí X chứa:
Khí X1 (M1) có a1 mol
Khí X2 (M2) có a2 mol
…
Khí Xn (Mn) có an mol
Khi đó:
Ví dụ: Tính tỉ khối hỗn hợp khí X gồm N2 (0,02 mol) và O2 (0,01 mol) so với khí oxi.
Khí N2 có = 2.14 = 28 g/mol và có số mol là 0,02 mol
Khí O2 có = 2.16 = 32 g/mol và có số mol là 0,01 mol
Áp dụng công thức:
* Nếu hỗn hợp X gồm 2 khí thì: với a là phần trăm số mol khí thứ nhất.
Ví dụ: hỗn hợp X gồm CO2 (75%) và CO (25%) có
Sơ đồ tư duy: Tỉ khối chất khí
Dạng 1: Tính tỉ khối của chất khí
* Một số lưu ý cần nhớ:
- Khí A đối với khí B:
dA/B =
- Khí A đối với không khí:
dA/kk =
* Một số ví dụ điển hình:
Ví dụ 1: Tỉ khối của khí B đối với oxi là 0,5 và tỉ khối của khí A đối với khí B là 2,125. Khối lượng mol của khí A là
Lời giải:
Ta có:
Mặt khác:
Vậy khối lượng mol của A là 34 g/mol
Ví dụ 2: Một khí X2 có tỉ khối hơi đối với khí axetilen (C2H2) bằng 2,731. Khí X2 là
Lời giải:
Áp dụng công thức tính tỉ khối:
Mà = 2.MX = 71 => MX = 35,5
Vậy khí cần tìm là Cl2
Ví dụ 3: Khí A có công thức phân tử dạng RO2, có tỉ khối hơi so với H2 là 32. Vậy A có công thức phân tử là:
Lời giải:
Khí A có tỉ khối so với H2 là 32
A có công thức phân tử là RO2 => M = MR + 2.MO = 64
=> MR = 64 – 2.16 = 32 => R là nguyên tố S
Vậy công thức phân tử của A là SO2
Dạng 2: Xác định tỉ khối của hỗn hợp khí
* Một số lưu ý cần nhớ:
B1: Xác định khối lượng mol trung bình của hỗn hợp khí
B2: Xác định tỉ khối của hỗn hợp khí
* Một số ví dụ điển hình:
Ví dụ 1: Tỉ khối của hỗn hợp chứa N2 và O3 theo tỉ lệ 1 : 2 so với không khí là:
Lời giải:
Gọi số mol của N2 là a mol => số mol của O3 là 2a mol
Khối lượng trung bình của hỗn hợp khí là:
=> tỉ khối của hỗn hợp so với không khí là:
Ví dụ 2: Tỉ khối của hỗn hợp chứa 4 gam metan (CH4) và 7 gam khí etilen (C2H4) so với không khí là:
Lời giải:
Số mol của CH4 là:
Số mol của C2H4 là:
=> khối lượng trung bình của hỗn hợp khí là:
=> tỉ khối của hỗn hợp so với không khí là:
Ví dụ 3: Một hỗn hợp X gồm H2 và O2 (không có phản ứng xảy ra) có tỉ khối so với không khí là 0,3276. Phần trăm theo số mol của khí H2 trong hỗn hợp là
Lời giải:
Gọi số mol của H2 và O2 trong hỗn hợp lần lượt là x và y mol
Tỉ khối của X so với không khí :
Công thức tính khối lượng trung bình của hỗn hợp X là
=> 2x + 32y = 9,5x + 9,5y => 7,5x = 22,5 => x = 3y
=> phần trăm số mol khí H2 là: