Với giải Luyện tập trang 40 Hóa học lớp 10 Chân trời sáng tạo chi tiết trong Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Luyện tập trang 40 Hóa học 10: Nitrogen là thành phần dinh dưỡng cần thiết cho sự sinh trưởng, phát triển và sinh sản của thực vật. Biết nitrogen có số hiệu nguyên tử là 7.
a) Viết cấu hình electron của nitrogen
b) Nitrogen là nguyên tố s, p, d hay f?
c) Nitrogen là kim loại, phi kim hay khí hiếm?
Phương pháp giải:
a)
Bước 1: Xác định số electron: 7
Bước 2: Viết thứ tự các lớp và phân lớp electron theo chiều tăng dần của năng lượng:
1s 2s 2p 3s 3p 4s 3d 4p
Bước 3: Điền các electron vào các phân lớp theo nguyên lí vững bền cho đến electron cuối cùng
b)
- Khối nguyên tố s gồm các nguyên tố thuộc nhóm IA và nhóm IIA: [Khí hiếm]ns1-2
- Khối nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến nhóm VIIIA (trừ nguyên tố He): [Khí hiếm]ns2np1-6
- Khối nguyên tố d gồm các nguyên tố thuộc nhóm B: [Khí hiếm](n-1)d1-10ns1-2
- Khối nguyên tố f gồm các nguyên tố xếp thành 2 hàng ở cuối bảng tuần hoàn:
[Khí hiếm](n-2)f0-14(n-1)d0-2ns2
c)
- Đối với nhóm A:
+ Có 1, 2, 3 electron ở lớp ngoài cùng => kim loại
+ Có 5, 6, 7 electron ở lớp ngoài cùng => phi kim
+ Có 8 electron ở lớp ngoài cùng => khí hiếm
- Tất cả nguyên tố nhóm B là kim loại
Lời giải:
a) Nitrogen có số hiệu nguyên tử: Z = 7
=> Cấu hình electron của nitrogen: 1s22s22p3
b) Nitrogen có cấu hình: [He] 2s22p3
=> Khối nguyên tố p
c) Nitrogen có 5 electron ở lớp ngoài cùng
=> Phi kim
Lý thuyết Bảng tuần hoàn các nguyên tố hóa học
1. Ô nguyên tố
- Mỗi nguyên tố hóa học được xếp vào một ô trong bảng tuần hoàn các nguyên tố hóa học, gọi là ô nguyên tố.
- Số thứ tự của một ô nguyên tố bằng số hiệu nguyên tử của nguyên tố hóa học trong ô đó.
- Ví dụ: Ô nguyên tố aluminium
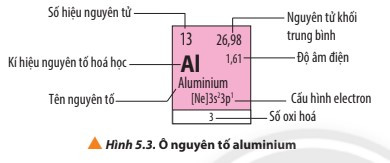
2. Chu kì
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là chu kì.
- Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì.
- Bảng tuần hoàn gồm 7 chu kì:
+ Các chu kì 1, 2 và 3 là các chu kì nhỏ.
+ Các chu kì 4, 5, 6 và 7 là các chu kì lớn.

3. Nhóm
- Nhóm là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau (trừ nhóm VIIIB), do đó có tính chất hóa học gần giống nhau và được xếp theo cột.
- Số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong nhóm.
- Bảng tuần hoàn hiện nay có 18 cột, chia thành 8 nhóm A (IA đến VIIIA) và 8 nhóm B (IB đến VIIIB). Mỗi cột tương ứng với một nhóm, riêng nhóm VIIIB có 3 cột.
- Electron hóa trị là những electron có khả năng tham gia hình thành liên kết hóa học. Chúng thường nằm ở lớp ngoài cùng hoặc cả ở phân lớp sát lớp ngoài cùng nếu phân lớp đó chưa bão hòa. Những nguyên tố có cùng số electron hóa trị thường có tính chất hóa học tương tự nhau.
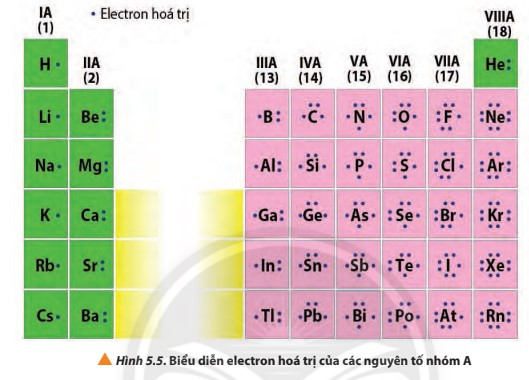
4. Phân loại nguyên tố dựa theo cấu hình electron và tính chất hóa học
- Các nguyên tố hóa học cũng có thể được chia thành các khối như sau:
+ Khối các nguyên tố s gồm các nguyên tố thuộc nhóm IA và nhóm IIA, có cấu hình electron: [Khí hiếm] ns1-2.
+ Khối các nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến VIIIA (trừ nguyên tố He), có cấu hình electron: [Khí hiếm] ns2np1-6.
+ Khối các nguyên tố d gồm các nguyên tố nhóm B, có cấu hình electron: [khí hiếm] (n – 1)d1-10ns1-2.
+ Khối các nguyên tố f gồm các nguyên tố xếp thành 2 hàng ở cuối bảng tuần hoàn, có cấu hình electron: [Khí hiếm] (n – 2)f0-14(n – 1)d0-2ns2 (trong đó n = 6 và n = 7)
- Dựa vào tính chất hóa học, người ta phân loại các nguyên tố hóa học thành:
+ Nguyên tố kim loại;
+ Nguyên tố phi kim;
+ Khí hiếm.
5. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
+ Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một chu kì.
+ Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp vào cùng một nhóm, trừ nhóm VIIIB.
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 2 trang 42 Hóa học 10: Dãy nào gồm các nguyên tố có tính chất hóa học tương tự nhau? Vì sao?...
Bài 3 trang 42 Hóa học 10: Viết cấu hình electron nguyên tử của các nguyên tố sau:...
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học