Với giải Luyện tập 2 trang 31 Hóa học lớp 10 Chân trời sáng tạo chi tiết trong Bài 4: Cấu trúc lớp vỏ electron của nguyên tử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
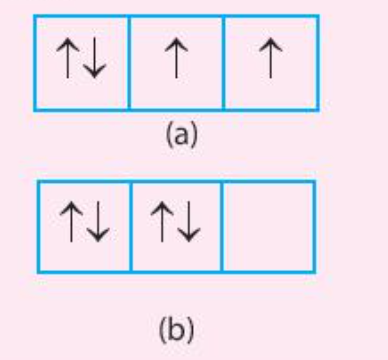
Luyện tập 2 trang 31 Hóa học 10: Trong các trường hợp (a) và (b) dưới đây, trường hợp nào có sự phân bố electron vào các orbital tuân theo và không tuân theo quy tắc Hund
Phương pháp giải:
Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa
Lời giải:
Cả 2 trường hợp (a) và (b) đều chưa đạt được phân lớp bão hòa
- Trường hợp (a) có 2 electron độc thân => Số electron độc thân đã tối đa
- Trường hợp (b) không có electron độc thân => Số electron độc thân chưa tối đa
=> Trường hợp (a) tuân theo quy tắc Hund, trường hợp (b) không tuân theo quy tắc Hund
Lý thuyết Cấu hình electron nguyên tử
1. Nguyên lí vững bền
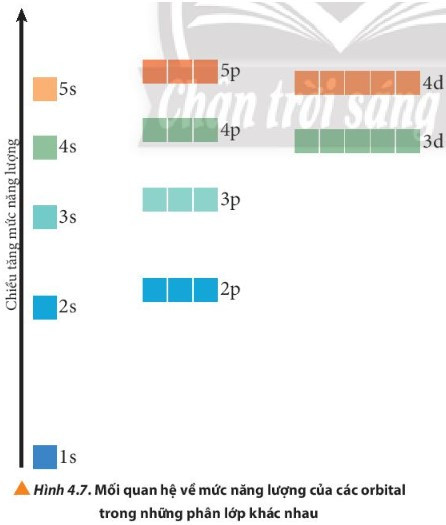
- Trong nguyên tử, các electron trên mỗi AO có một mức năng lượng xác định. Người ta gọi mức năng lượng này là mức năng lượng AO nguyên tử.
- Nguyên lí vững bền: Ở trạng thái cơ bản, các electron trong nguyên tử chiếm lần lượt những orbital có mức năng lượng từ thấp đến cao: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p …
- Các electron trên các AO khác nhau của cùng một phân lớp có năng lượng như nhau.
Ví dụ: Phân lớp 3p có 3 AO 3px, 3py, 3pz; các electron của các AO p trong phân lớp này tuy có sự định hướng trong không gian khác nhau nhưng chúng có cùng mức năng lượng AO.
2. Nguyên lí Pauli
- Để biểu diễn orbital nguyên tử, người ta sử dụng các ô vuông, gọi là ô lượng tử. Mỗi ô lượng tử ứng với một AO. Mỗi AO chứa tối đa 2 electron.
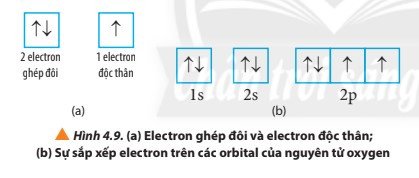
+ Nếu trong AO chỉ chứa 1 electron thì electron đó gọi là electron độc thân (kí hiệu bởi 1 mũi tên hướng lên ↑).
+ Nếu AO chứa đủ 2 electron thì các electron đó gọi là electron ghép đôi (kí hiệu bởi hai mũi tên ngược chiều nhau ↑↓).
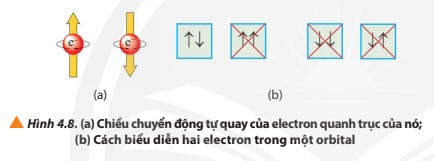
- Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau.
- Dựa vào nguyên lí Pauli, ta dễ dàng xác định được số AO và số electron tối đa trong mỗi lớp và phân lớp:
+ Số AO tối đa trong lớp n là n2 (n ≤ 4).
+ Số electron tối đa trong lớp n là 2n2 (n ≤ 4).
Ví dụ: Số AO tối đa trong lớp thứ 2 là 22 = 4
Số electron tối đa trong lớp thứ 2 là 2.22 = 8 electron.
3. Quy tắc Hund
- Các phân lớp: s2; p6; d10; f14 chứa đủ số electron tối đa gọi là phân lớp bão hòa.
- Các phân lớp: s1; p3; d5; f7 chứa một nửa số electron tối đa gọi là phân lớp nửa bão hòa.
- Các phân lớp chưa đủ số electron tối đa gọi là phân lớp chưa bão hòa.
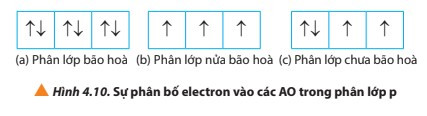
- Quy tắc Hund: Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa.
4. Cách viết cấu hình electron nguyên tử
- Cấu hình electron nguyên tử biểu diễn sự phân bố electron trong vỏ nguyên tử trên các phân lớp thuộc các lớp khác nhau.
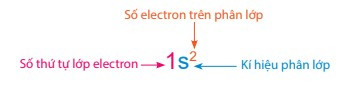
- Cấu hình electron nguyên tử phải được viết theo thứ tự các lớp electron và phân lớp trong mỗi lớp. Trong đó:
+ Số thứ tự lớp electron được viết bằng các số tự nhiên (n = 1, 2, 3, …)
+ Phân lớp được kí hiệu bằng các chữ cái thường s, p, d, f.
+ Số electron của từng phân lớp được ghi bằng chỉ số ở phía trên, bên phải kí hiệu của phân lớp.
- Quy ước cách biểu diễn sự phân bố electron trên các phân lớp thuộc các lớp như sau:
- Cách viết cấu hình electron:
+ Bước 1: Xác định số electron của nguyên tử.
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong nguyên tử.
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron.
Ví dụ:
K (Z = 19): Thứ tự mức năng lượng orbital: 1s22s22p63s23p64s1.
Cấu hình electron: 1s22s22p63s23p64s1 hoặc viết gọn là: [Ar]4s1.
[Ar] là kí hiệu cấu hình electron nguyên tử của nguyên tố argon, là khí hiếm gần nhất đứng trước K.
Cấu hình electron theo orbital:![]()
5. Đặc điểm electron lớp ngoài cùng của nguyên tử
- Dựa vào số lượng electron lớp ngoài cùng của nguyên tử nguyên tố, có thể dự đoán một nguyên tố là kim loại, phi kim hay khí hiếm.
+ Các nguyên tử có 1, 2, 3 electron ở lớp ngoài cùng là các nguyên tử của nguyên tố kim loại (trừ H, He, B).
+ Các nguyên tử có 5, 6, 7 electron ở lớp ngoài cùng thường là nguyên tử của các nguyên tố phi kim.
+ Các nguyên tử có 4 electron ở lớp ngoài cùng có thể là nguyên tử của nguyên tố kim loại hoặc phi kim.
+ Các nguyên tử có 8 electron ở lớp ngoài cùng là nguyên tử của nguyên tố khí hiếm (trừ He có 2 electron ở lớp ngoài cùng).
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi 14 trang 32 Hóa học 10: Cấu hình electron của một nguyên tử cho biết những thông tin gì?...
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học