Với giải Câu hỏi 4 trang 27 Hóa học lớp 10 Chân trời sáng tạo chi tiết trong Bài 4: Cấu trúc lớp vỏ electron của nguyên tử giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
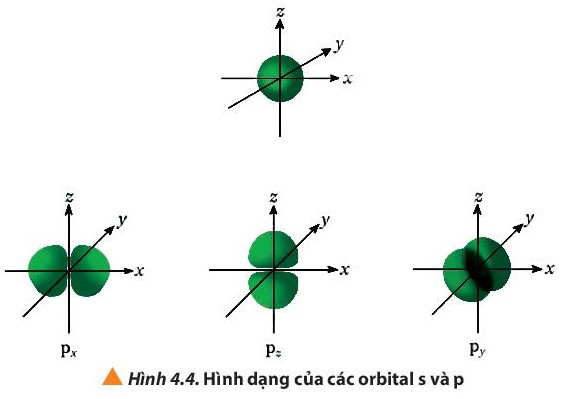
Câu hỏi 4 trang 27 Hóa học 10: Quan sát Hình 4.4, hãy cho biết điểm giống và khác nhau giữa các orbital p: px, py, pz
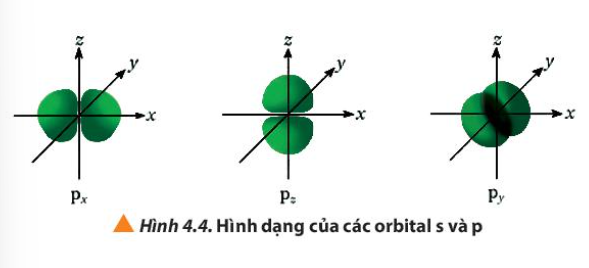
Phương pháp giải:
Quan sát Hình 4.4 và so sánh
Lời giải:
|
|
px |
py |
pz |
|
Giống nhau |
Đều có hình dạng là số 8 nổi |
||
|
Khác nhau |
Nằm trên trục Ox |
Nằm trên trục Oy |
Nằm trên trục Oz |
Lý thuyết Sự chuyển động của electron trong nguyên tử
1. Sự chuyển động của electron trong nguyên tử
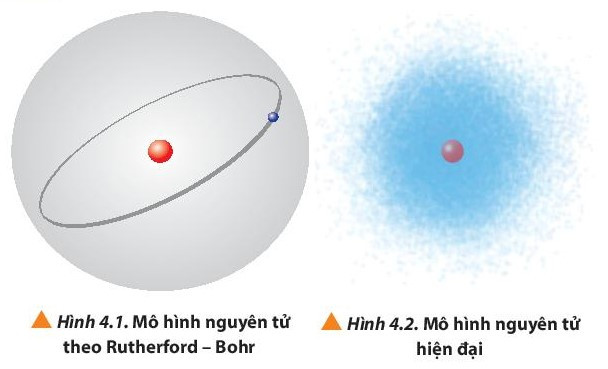
- Theo mô hình nguyên tử của Rutherford – Bohr (mô hình hành tinh nguyên tử), các electron chuyển động trên những quỹ đạo hình tròn hay bầu dục xác định xung quanh hạt nhân.
- Theo mô hình hiện đại, trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
2. Orbital nguyên tử
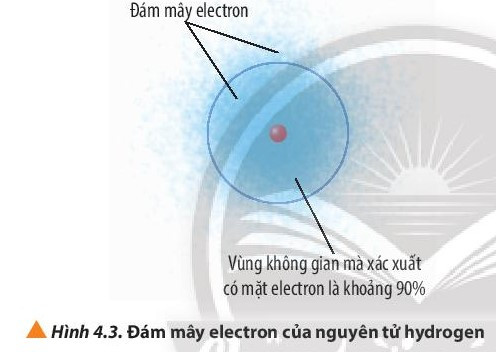
- Orbital nguyên tử (Atomic Orbital, viết tắt AO) là khu vực không gian xung quanh hạt nhân nguyên tử mà tại đó xác suất tìm thấy electron là lớn nhất (khoảng 90%).
- Một số AO thường gặp: s, p, d, f
- Các AO có hình dạng khác nhau: AO s có dạng hình cầu, AO p có dạng hình số tám nổi, AO d và f có hình dạng phức tạp.
Xem thêm các bài giải Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Câu hỏi 14 trang 32 Hóa học 10: Cấu hình electron của một nguyên tử cho biết những thông tin gì?...
Xem thêm các bài giải SGK Hóa học lớp 10 Chân trời sáng tạo hay, chi tiết khác:
Bài 4: Cấu trúc lớp vỏ electron của nguyên tử
Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Bài 7: Định luật tuần hoàn - Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học