Tailieumoi.vn xin giới thiệu phương trình 2Al2O3 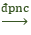
Phương trình 2Al2O3 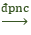
1. Phương trình điện phân nóng chảy (đpnc):
2Al2O3 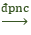
2. Hiện tượng nhận biết phản ứng
- Có khí không màu thoát ra.
3. Điều kiện phản ứng
- Điều kiện 900oC, điện phân nóng chảy.
4. Mở rộng về nhôm oxit: Al2O3
4.1. Tính chất vật lý
Nhôm oxit là chất rắn màu trắng, không tan trong nước, không tác dụng với nước, nóng chảy ở nhiệt độ trên 2050oC.
4.2. Tính chất hóa học
Nhôm oxit là oxit lưỡng tính, vừa tác dụng với dung dịch axit, vừa tác dụng với dung dịch kiềm.
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
4.3. Ứng dụng
Trong tự nhiên, nhôm oxit tồn tại cả ở dạng ngậm nước và dạng khan.
- Dạng oxit ngậm nước là thành phần chủ yếu của quặng boxit dùng để sản xuất nhôm.
- Dạng oxit khan, có cấu tạo tinh thể là đá quý được dùng làm đồ trang sức, chế tạo đá mài …
- Bột nhôm oxit dùng trong công nghiệp sản xuất chất xúc tác cho tổng hợp hữu cơ.
5. Cách thực hiện phản ứng
+ Ở catot (cực âm): Al3+ + 3e → Al
+ Ở anot (cực dương): 2O2- → O2 + 4e
Phương trình điện phân: 2Al2O3 4Al + 3O2
Vai trò của criolit:
+ Giảm nhiệt độ nóng chảy của Al2O3.
+ Tăng khả năng dẫn điện của dung dịch điện phân.
+ Tạo lớp xỉ trên bề mặt, ngăn cản quá trình oxi hóa Al bởi oxi không khí.
6. Bạn có biết
Trong công nghiệp, kim loại kiềm và kim loại kiềm thổ được điều chế bằng phương pháp điện phân nóng chảy muối halogenua tương ứng:
2MCln 
7. Bài tập liên quan
Ví dụ 1: Dãy kim loại nào dưới đây điều chế được bằng cách điện phân nóng chảy muối clorua ?
A. Al, Mg, Fe
B. Al, Mg, Na.
C. Na, Ba, Mg
D. Al, Ba, Na.
Hướng dẫn giải
Chọn C.
Trong công nghiệp, kim loại kiềm và kim loại kiềm thổ được điều chế bằng phương pháp điện phân nóng chảy muối halogenua tương ứng:
2MCln 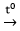
Tuy nhiên, Al được điều chế bằng cách điện phân nóng chảy Al2O3:
2Al2O3 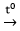
Ví dụ 2: Để sản xuất nhôm trong công nghiệp người ta thường:
A. Điện phân dung dịch AlCl3
B. Cho Mg vào dung dịch Al2(SO4)3.
C. Cho CO dư đi qua Al2O3 nung nóng
D. Điện phân Al2O3 nóng chảy có mặt criolit.
Hướng dẫn giải
Chọn D.
2Al2O3 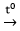
Ví dụ 3: Giải thích tại sao để điều chế Al người ta điện phân Al2O3 nóng chảy mà không điện phân AlCl3 nóng chảy là:
A. AlCl3 nóng chảy ở nhiệt độ cao hơn Al2O3.
B. AlCl3 là hợp chất cộng hóa trị nên không nóng chảy mà thăng hoa.
C. Điện phân AlCl3 tạo ra Cl2 rất độc.
D. Điện phân Al2O3 cho ra Al tinh khiết hơn.
Hướng dẫn giải
Chọn B.
Trên 180oC thì AlCl3 đã thăng hoa và nhị hợp thành Al2Cl6 nên không điện phân được nữa.
Ví dụ 4: Để điều chế Al kim loại ta có thể dùng phương pháp nào trong các phương pháp sau đây?
A.Dùng Zn đẩy AlCl3 ra khỏi muối
B.Dùng CO khử Al2O3
C.Điện phân nóng chảy Al2O3
D.Điện phân dung dịch AlCl3
Hướng dẫn giải:
Kim loại nhôm được điều chế bằng phương pháp điện phân nóng chảy oxit nhôm
2Al2O3 4Al + 3O2
Ví dụ 5: Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm?
A. Al tác dụng với Fe2O3 nung nóng. B. Al tác dụng với CuO nung nóng.
C. Al tác dụng với Fe3O4 nung nóng. D. Al tác dụng với axit H2SO4 đặc nóng.
Hướng dẫn giải
Đáp án D
Phản ứng nhiệt nhôm là phản ứng cho nhôm tác dụng với oxit kim loại ở nhiệt độ cao.
Ví dụ 6: Lấy hỗn hợp gồm Al, Al2O3 và Fe2O3 ngâm trong dung dịch NaOH dư. Phản ứng xong, chất bị hoà tan là:
A. Al, Al2O3. B. Fe2O3, Fe.
C. Al, Fe2O3.D. Al, Al2O3, Fe2O3.
Hướng dẫn giải
Đáp án A
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Al2O3 + 2NaOH → 2NaAlO2 + H2O.
Ví dụ 7: Dẫn khí CO dư qua hỗn hợp bột gồm MgO, CuO, Al2O3 và FeO, nung nóng. Sau khi các phản ứng xảy ra hoàn toàn thu được hỗn hợp rắn Y. Số oxit kim loại trong Y là
A. 3 B. 1 C. 4 D. 2
Hướng dẫn giải:
CO khử được oxit kim loại đứng sau Al trong dãy hoạt động hóa học
→ Sau khi phản ứng hoàn toàn thu được Y gồm: MgO, Cu, Al2O3, Fe
Ví dụ 8: Nhôm bền trong môi trường nước và không khí là do
A. nhôm là kim loại kém hoạt động.
B. có màng oxit Al2O3 bền vững bảo vệ.
C. có màng hiđroxit Al(OH)3 bền vững bảo vệ.
D. nhôm có tính thụ động với không khí và nước.
Hướng dẫn giải
Đáp án B
Nhôm là kim loại hoạt động mạnh.Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với oxi trong không khí và nước, kể cả khi đun nóng.
Ví dụ 9: Trong công nghiệp, Al được sản xuất từ quặng boxit
A. bằng phương pháp điện phân nóng chảy.
B. bằng phương pháp nhiệt luyện .
C. bằng phương pháp thủy luyện.
D. Trong lò cao.
Hướng dẫn giải
Đáp án A
Trong công nghiệp, Al được sản xuất từ quặng boxit bằng phương pháp điện phân nóng chảy.
2Al2O3 4Al + 3O2
Ví dụ 10: Cho hỗn hợp X gồm Al và Al2O3 có tỉ lệ khối lượng tương ứng là 0,18 : 1,02. Cho X tan trong dung dịch NaOH vừa đủ thu được dung dịch Y và 0,672 lít khí H2 (đktc). Cho Y tác dụng với 200 ml dung dịch HCl được kết tủa Z. Nung Z ở nhiệt độ cao đến khối lượng không đổi được 3,57g chất rắn. Nồng độ mol của dung dịch HCl là
A. 0,35M hoặc 0,45M. B. 0,07M hoặc 0,11M.
C. 0,07M hoặc 0,09M. D. 0,35M hoặc 0,55M.
Hướng dẫn giải
Đáp án D
= 0,03
Bảo toàn electron: 3.nAl = 2.
→ nAl = 0,02 → mAl = 0,54g
Al và Al2O3 có tỉ lệ khối lượng tương ứng là 0,18 : 1,02
→=
→bđ = 0,03 mol
Bảo toàn nguyên tố Al → = nAl + 2. bđ = 0,08 mol
thu được = 3,57 : 102 = 0,035 mol
= 0,07 mol
Trường hợp 1: NaAlO2 + HCl + H2O → Al(OH)3 + NaCl
nHCl = = 0,07 mol
→ CM HCl= = 0,35M
Trường hợp 2:
→ nHCl = 0,11 mol
→ CM HCl= = 0,55M
8. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
2Al2O3 + 9C 
Al2O3+ 6HCl → 2AlCl3+ 3H2O
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Al2O3 + 6HNO3 → 2Al(NO3)3 + 3H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al2O3 + 2KOH → 2KAlO2 + H2O
Al2O3 + Ca(OH)2 → H2O + Ca(AlO2)2