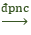Tailieumoi.vn xin giới thiệu phương trình 2Al + 4BaO → 3Ba + Ba(AlO2)2 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học của Nhôm. Mời các bạn đón xem:
Phương trình 2Al + 4BaO → 3Ba + Ba(AlO2)2
1. Phương trình phản ứng hóa học:
2Al + 4BaO → 3Ba + Ba(AlO2)2
2. Hiện tượng nhận biết phản ứng
- Phản ứng tạo thành bari và bari aluminat
3. Điều kiện phản ứng
- Nhiệt độ: 1100 - 1200oC
4. Tính chất hoá học
a. Tính chất hoá học của Nhôm
Nhôm là kim loại có tính khử mạnh: Al → Al3+ + 3e
Tác dụng với phi kim
a) Tác dụng với oxi
Al bền trong không khí ở nhiệt độ thường do có lớp màng oxit Al2O3 rất mỏng bảo vệ.
b) Tác dụng với phi kim khác
Tác dụng với axit
+ Axit không có tính oxi hóa: dung dịch axit HCl, H2SO4 loãng
2Al + 6HCl → 2AlCl3 + 3H2↑
+ Axit có tính oxi hóa mạnh: dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng.
Nhôm bị thụ động hoá trong dung dịch HNO3 đặc, nguội hoặc H2SO4 đặc nguội.
Tác dụng với oxit kim loại( Phản ứng nhiệt nhôm)
Lưu ý: Nhôm chỉ khử oxit của các kim loại đứng sau nhôm
Tác dụng với nước
- Phá bỏ lớp oxit trên bề mặt Al (hoặc tạo thành hỗn hống Al-Hg thì Al sẽ phản ứng với nước ở nhiệt độ thường)
2Al + 6H2O → 2Al(OH)3↓ + 3H2↑
Tác dụng với dung dịch kiềm
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Tác dụng với dung dịch muối
- Al đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
b. Tính chất hoá học của BaO
- Mang đầy đủ tính chất hóa học của oxit bazơ.
Tác dụng với nước:
BaO + H2O → Ba(OH)2
Tác dụng với axit:
BaO + 2HCl → BaCl2 + H2O
BaO + H2SO4 → BaSO4 + H2O
Tác dụng với oxit axit:
BaO + CO2 → BaCO3
5. Cách thực hiện phản ứng
- Cho Nhôm tác dụng với BaO
6. Bài tập liên quan
Ví dụ 1: Cho một lá nhôm vào ống nghiệm chứa dung dịch Hg(NO3)2, thấy có một lớp thủy ngân bám trên bề mặt nhôm. Hiện tượng tiếp theo quan sát được là:
A. khí hiđro thoát ra mạnh.
B. khí hiđro thoát ra sau đó dừng lại ngay.
C. lá nhôm bốc cháy.
D. lá nhôm tan ngay trong thủy ngân và không có phản ứng.
Đáp án: A
Hướng dẫn giải
2Al + 3Hg(NO3)2 → 2Al(NO3)3 + 3Hg
Al sẽ tạo với Hg hỗn hống. Hỗn hống Al tác dụng với nước
2Al + 6H2O → 2Al(OH)3 + 3H2
Ví dụ 2: Cho sơ đồ phản ứng : Al → X → Al2O3 → Al
X có thể là
A. AlCl3.
B. NaAlO2.
C. Al(NO3)3.
D. Al2(SO4)3.
Đáp án: C
Ví dụ 3: Trong các cặp chất sau đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
A. AlCl3 và Na2CO3
B. HNO3 và NaHCO3
C. NaAlO2 và KOH
D. NaCl và AgNO3
Đáp án: C
Hướng dẫn giải
NaAlO2 và KOH không xảy ra phản ứng hóa học
7. Một số phương trình phản ứng hoá học khác của Nhôm (Al) và hợp chất:
2Al + Ca(OH)2 + 2H2O → 3H2↑ + Ca(AlO2)2
2Al + 2H2O + Ba(OH)2 → 3H2↑ + Ba(AlO2)2
2Al + 2H2O + 2KOH → 3H2↑ + 2KAlO2
2Al + 2H2O + 2NaOH → 3H2↑ + 2NaAlO2
Phương trình điện phân nóng chảy: 2Al2O3