Tailieumoi.vn xin giới thiệu phương trình CH3COOH + Na → CH3COONa + H2 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình CH3COOH + Na → CH3COONa + H2
1. Phương trình phản ứng hóa học
2CH3COOH + 2Na → 2CH3COONa + H2
2. Hiện tượng nhận biết phản ứng.
- Mẩu Na tan dần, có khí thoát ra.
3. Điều kiện phản ứng
- Nhiệt độ thường
4. Phương trình ion thu gọn của phản ứng CH3COOH tác dụng với Na
2CH3COOH + 2Na → 2CH3COO- + 2Na+ + H2↑
Cách viết phương trình ion thu gọn của phản ứng:
Bước 1: Viết phương trình phân tử:
2CH3COOH + 2Na → 2CH3COONa + H2↑
Bước 2: Chuyển các chất vừa dễ tan, vừa điện li mạnh về ion. Các chất kết tủa, chất khí, chất điện li yếu để nguyên dưới dạng phân tử:
2CH3COOH + 2Na → 2CH3COO- + 2Na+ + H2↑
Bước 3: Do 2 vế không có ion nào giống nhau, do đó phương trình ion ở bước 2 cũng chính là phương trình ion thu gọn của phản ứng.
5. Bản chất của các chất tham gia phản ứng
a. Bản chất của CH3COOH (Axit axetic)
CH3COOH là một axit hữu cơ. Axit axetic ăn mòn các kim loại và tạo ra khí hidro và muối axetat.
b. Bản chất của Na (Natri)
Na có tính khử rất mạnh dễ dàng khử ion H+ trong dung dịch axit thành hidro tự do.
6. Tính chất hóa học
6.1. Tính chất hóa học của CH3COOH
Gồm 1 nhóm -OH liên kết với nhóm C=O tạo thành nhóm -COOH, chính nhóm –COOH (Cacboxyl) làm cho phân tử có tính axit.
Axit axetic là một axit yếu, yếu hơn các axit HCl, H2SO4, HNO3, H2SO3 nhưng mạnh hơn axit cacbonic H2CO3. Axit axetic cũng có đầy đủ tính chất của một axit.
Axit axetic tác dụng với oxit bazơ, bazơ tạo thành muối và nước.
CH3COOH + NaOH → CH3COONa + H2O
CH3COOH + CaO → (CH3COO)2Ca + H2O
2CH3COOH + 2Na → 2CH3COONa + H2↑
2CH3COOH + BaCO3 → (CH3COO)2Ba + CO2↑ + H2O.
Axit axetic tác dụng với rượu tạo ra este và nước (xúc tác là H2SO4 đặc, nóng):
CH3COOH + HO-C2H5 ⇔ CH3COOC2H5 + H2O
6.2. Tính chất hóa học của Na
a. Tác dụng với phi kim
4Na + O2 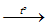
2Na + Cl2 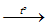
- Khi đốt trong không khí hay trong oxi, Na cháy tạo thành các oxit (oxit thường, peoxit và supeoxit) và cho ngọn lửa có màu vàng đặc trưng.
b. Tác dụng với axit
- Natri dễ dàng khử ion H+ trong dung dịch axit loãng (HCl, H2SO4 loãng...) thành hidro tự do.
2Na + 2HCl → 2NaCl + H2.
2Na + H2SO4 → Na2SO4 + H2.
c. Tác dụng với nước
- Natri đều tác dụng mãnh liệt với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Na + 2H2O → 2NaOH + H2.
d. Tác dụng với hidro
- Natri tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành natri hidrua.
2Na (lỏng) + H2 (khí) 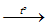
7. Mở rộng kiến thức về axit axetic
7.1.Tính axit
- Trong dung dịch, axit axetic phân li thuận nghịch:
CH3COOH ⇄ H+ + CH3COO-
Dung dịch axit axetic làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với bazơ, oxit bazơ tạo thành muối và nước. Ví dụ:
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + ZnO → (CH3COO)2Zn + H2O
- Tác dụng với muối:
2CH3COOH + CaCO3 → (CH3COO)2Ca + H2O + CO2
- Tác dụng với kim loại trước hiđro:
2CH3COOH + Zn → (CH3COO)2Zn + H2
7.2. Phản ứng thế nhóm –OH
- Phản ứng giữa axit axetic và ancol tạo thành este và nước được gọi là phản ứng este hóa. Tổng quát:
CH3COOH + R’OHCH3COOR’ + H2O
- Đặc điểm: phản ứng thuận nghịch, xúc tác H2SO4 đặc.
- Ví dụ:
CH3COOH + C2H5OH CH3COOC2H5 + H2O
7.3. Điều chế
a. Phương pháp lên men giấm(phương pháp cổ truyền sản xuất axit axetic)
C2H5OH + O2 CH3COOH + H2O
b. Oxi hóa anđehit axetic:
2CH3CHO + O2 2CH3COOH
c. Từ metanol:
CH3OH + CO CH3COOH
Đây là phương pháp hiện đại để sản xuất axit axetic.
8. Cách thực hiện phản ứng
- Cho CH3COOH tác dụng Na.
9. Bạn có biết
- Hiện tại chúng tôi không có thêm bất kỳ thông tin nào thêm về phương trình này.
10. Bài tập liên quan
Câu 1. Axit axetic (CH3COOH) tác dụng được với tất cả các chất trong dãy nào sau đây?
A. K, CuO, HCl
B. KOH, K, CaCO3
C. KOH, Cu, NaCl
D. K, KCl, CuO
Lời giải:
Đáp án: B
Câu 2. Axit axetic tác dụng được với dung dịch nào sau đây?
A. C2H5ONa
B. (NH4)2CO3
C. C6H5ONa
D. Cả A, B, C
Lời giải:
Đáp án: D
Giải thích:
CH3COOH + C2H5ONa → CH3COONa + C2H5OH
2CH3COOH + (NH4)2CO3 → 2CH3COONH4 + CO2 + H2O
Câu 3. Thực hiện phản ứng este hóa m gam CH3COOH bằng một lượng vừa đủ C2H5OH (xúc tác H2SO4 đặc, đun nóng) thu được 1,76 gam este (H = 100%). Giá trị của m là:
A. 2,1
B. 1,2
C. 2,4
D. 1,4
Lời giải:
Đáp án: B
Giải thích:
Cứ 60 g (1mol) CH3COOH 88 g CH3COOC2H5
=> m = 1,76/88. 60 = 1,2 g
Câu 4. Phát biểu nào sau đây không đúng?
A. để sản xuất phenol trong công nghiệp người ta đi từ cumen.
B. axit axetic, axit fomic, etanol, metanol tan vô hạn trong nước.
C. trong công nghiệp để tráng gương, tráng ruột phích người ta dùng glucozơ.
D. phenol là chất lỏng tan tốt trong nước ở nhiệt độ thường.
Lời giải:
Đáp án: D
Câu 5. Nhận xét nào sau đây không đúng?
A. Metyl axetat là đồng phân của axit axetic.
B. Các este thường nhẹ hơn nước và ít tan trong nước.
C. Poli(metyl metacrylat) được dùng làm thủy tinh hữu cơ.
D. Metyl fomat có nhiệt độ sôi thấp hơn axit axetic.
Lời giải:
Đáp án: A
Câu 6. Axit axetic CH3COOH không phản ứng với chất nào sau đây?
A. NaOH.
B. Na2CO3.
C. NaCl.
D. Na.
Lời giải:
Đáp án: C
Giải thích:
CH3COOH không phản ứng với NaCl.
Phương trình hóa học:
CH3COOH + NaOH → CH3COONa + H2O
2CH3COOH + Na2CO3 → 2CH3COONa + CO2 + H2O
2CH3COOH + 2Na → 2CH3COONa + H2
Câu 7. Phát biểu nào sau đây đúng khi nói về axit fomic và axit axetic?
A. Hai axit trên đều tác dụng với Mg, Na2CO3, CuO, dung dịch AgNO3/NH3.
B. Tính axit của axit fomic mạnh hơn axit axetic. Axit fomic tác dụng với Cu(OH)2/NaOH, đun nóng tạo ra Cu2O, còn axit axetic không có phản ứng này.
C. Hai axit trên đều được điều chế từ CH4 qua một phản ứng.
D. Nhiệt độ sôi của axit fomic cao hơn nhiệt độ sôi của axit axetic.
Lời giải:
Đáp án: B
Câu 8.Các sản phẩm thu được khi đốt cháy hoàn toàn 3 gam axit hữu cơ X được dẫn lần lượt qua bình 1 đựng H2SO4 đặc và bình 2 đựng dung dịch NaOH. Sau thí nghiệm thấy khối lượng bình 1 tăng 1,8 gam và khối lượng bình 2 tăng 4,4 gam. Công thức cấu tạo của X là
A. HCOOH.
B. C2H5COOH.
C. CH3COOH.
D. A hoặc B hoặc C.
Lời giải:
Đáp án C
Khối lượng bình 1 tăng chính là khối lượng H2O, khối lượng bình 2 tăng chính là khối lượng CO2.
Theo bài ra ta lại có: nCO2 = nH2O = 0,1 mol
BTKL: mO = 3 – 0,1.12 – 0,1.2= 1,6 g
=> nO = 0,1 mol
Bảo toàn O có nX =
Vậy công thức cấu tạo của X là CH3COOH.
Câu 9.Chất X (có M = 60 và chứa C, H, O). Chất X phản ứng được với Na, NaOH, NaHCO3, tên gọi của X là
A. axit fomic. B. metyl fomat.
C. axit axetic. D. ancol propylic.
Lời giải:
Đáp án C
X phản ứng được với Na, NaOH, NaHCO3 nên X là axit.
Lại có MX = 60. Vậy X là axit axetic (CH3COOH).
Câu 10. Đốt cháy hết 1 thể tích hơi axit A thu được 2 thể tích CO2 đo ở cùng điều kiện, A là
A. HCOOH.
B. HOOC - COOH.
C. CH3COOH.
D. B và C đúng.
Lời giải:
Đáp án D
1A → 2CO2 => A chứa 2 nguyên tử C
Theo các đáp án đã cho => A là HOOC-COOH hoặc CH3COOH.
Câu 11. Hỗn hợp X gồm axit axetic, axit fomic và axit oxalic. Khi cho m gam X tác dụng với NaHCO3 (dư) thì thu được 15,68 lít khí CO2 (đktc). Mặt khác, đốt cháy hoàn toàn m gam X cần 8,96 lit khí O2 (đktc), thu được 35,2 gam CO2 và a mol H2O. Giá trị của a là:
A. 0,3
B. 0,2
C. 0,6
D. 0,8
Lời giải:
Đáp án C
- Xét phản ứng của hỗn hợp X với NaHCO3:
Bảo toàn nguyên tố: n-COOH trong X = nCO2 = 0,7 mol
=> n O trong X = 1,4 mol
- Xét phản ứng đốt cháy hỗn hợp X:
BTNT: nO trong X + 2nO2 = 2nCO2 + nH2O
=> nH2O = 1,4 + 0,4.2 - 0,8.2 = 0,6 mol.
Câu 12. Trung hòa 400 ml dung dịch axit axetic 0,5M bằng dung dịch NaOH 0,5M. Thể tích dung dịch NaOH cần dùng là
A. 100 ml.
B. 200 ml.
C. 300 ml.
D. 400 ml.
Lời giải:
Đáp án D
0,2 → 0,2 mol
VNaOH = 0,2 : 0,5 = 0,4 lít = 400 ml
Câu 13. Dung dịch axit axetic phản ứng được với tất cả các chất trong dãy nào sau đây?
A. Cu, CuO, HCl.
B. NaOH, Cu, NaCl.
C. Na, NaCl, CuO.
D. NaOH, Na, CaCO3.
Lời giải:
Đpá án D
CH3COOH không tác dụng với NaCl, Cu, HCl
Câu 14. Trung hòa hoàn toàn 1,8 gam một axit hữu cơ đơn chức bằng dung dịch NaOH vừa đủ rồi cô cạn dung dịch sau phản ứng được 2,46 gam muối khan. Axit là
A. HCOOH.
B. CH2=CHCOOH.
C. CH3CH2COOH.
D. CH3COOH.
Lời giải:
Đáp án D
Ta có sơ đồ: RCOOH → RCOONa
Cứ 1 mol RCOOH phản ứng tạo 1 mol → m tăng = 22 gam
Cứ a mol RCOOH phản ứng tạo a mol có m tăng = 2,46 - 1,8 = 0,66 gam
=> naxit = 0,03 mol => Maxit = 1,8 : 0,03 = 60
Vậy axit là CH3COOH.
11. Một số phương trình phản ứng hoá học khác của Natri (Na) và hợp chất:
2Na + Cl2→ 2NaCl
2Na + Br2 → 2NaBr
2Na + I2 → 2NaI
4Na + O2 → 2Na2O
2Na + 2H2O → 2NaOH + H2
2Na + S → 2Na2S
Na + 2HCl → NaCl + H2
Na + 2H2SO4 → Na2SO4 + H2
6Na + 2H3PO4 → 2Na3PO4 + 3H2
2Na + H3PO4 → Na2HPO4 + H2
2Na + 2H3PO4 → 2NaH2PO4 + H2
2Na + 2HF → 2NaF + H2
2Na + CuSO4 + 2H2O → Na2SO4 + H2 + Cu(OH)2
2Na + FeSO4 + 2H2O → Na2SO4 + H2 + Fe(OH)2
6Na + Al2(SO4)3 + 6H2O → 3Na2SO4 + H2 + 2Al(OH)3
2Na + ZnSO4 + 2H2O → Na2SO4 + H2 + Zn(OH)2