Tailieumoi.vn xin giới thiệu phương trình Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O
1. Phương trình phản ứng hóa học:
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
2. Hướng dẫn chi tiết cân bằng phản ứng Zn tác dụng HNO3
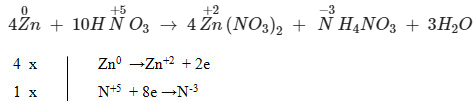
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
2. Hiện tượng nhận biết phản ứng.
- Chất rắn màu xám nhạt Kẽm (Zn) tan dần.
3. Điều kiện phản ứng
- Nhiệt độ thường
4. Phương trình ion rút gọn Zn + HNO3
Phương trình phân tử phản ứng Zn tác dụng HNO3
4Zn + 10HNO3 → 4Zn(NO3)2 + NH4NO3 + 3H2O
Phương trình ion rút gọn:
5. Bản chất của các chất tham gia phản ứng
a. Bản chất của Zn (Kẽm)
- Trong phản ứng trên Zn là chất khử.
- Zn là kim loại hoạt động có tính khử mạnh tác dụng được với các axit.
a. Bản chất của HNO3 (Axit nitric)
- Trong phản ứng trên HNO3 là chất oxi hoá.
- Đây là một monoaxit mạnh, có tính oxi hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ.
6. Tính chất hóa học
6.1. Tính chất hóa học của Zn (Kẽm)
- Kẽm là kim loại hoạt động có tính khử mạnh Zn → Zn2+ + 2e
a. Tác dụng với phi kim
- Zn tác dụng trực tiếp với nhiều phi kim.
2Zn + O2 → 2ZnO
Zn + Cl2 → ZnCl2
b. Tác dụng với axit
- Với các dung dịch axit HCl, H2SO4 loãng:
Zn + 2HCl → ZnCl2 + H2
- Với dung dịch HNO3, H2SO4 đặc:
Zn + 4HNO3 đ → Zn(NO3)2 + 2NO2 + 2H2O
c. Tác dụng với H2O
- Phản ứng này hầu như không xảy ra vì trên bề mặt của kẽm có màng oxit bảo vệ.
d. Tác dụng với bazơ
- Kẽm tác dụng với dung dịch bazơ mạnh: NaOH, KOH, Ca(OH)2....
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
6.2. Tính chất hóa học của HNO3 (Axit nitric)
Axit nitric được xếp hạng trong danh sách những axit mạnh nhất. Đây là một axit khan – một monoaxit mạnh có thể nitrat hóa nhiều hợp chất vô cơ với hằng số cân bằng axit (pKa) = -2.
Axit nitric phân li hoàn toàn thành các ion H+ và NO3- trong dung dịch loãng. Dung dịch HNO3 làm quỳ tím chuyển đỏ.
HNO3 có tác dụng với oxit bazơ, bazơ và muối của axit yếu hơn tạo ra muối nitrat.
Ví dụ:
CuO + 2HNO3 → Cu(NO3)2 + H2O
CaCO3 + 2HNO3 → Ca(NO3)2 + H2O + CO2
Ba(OH)2 + 2HNO3 → Ba(NO3)2 + 2H2O
Axit nitric tác dụng với oxit bazơ, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
Ví dụ:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
Axit nitric cũng là 1 trong những axit có tính oxi hóa mạnh. Nó có thể bị khử đến các sản phẩm khác nhau của nitơ, phụ thuộc vào nồng độ axit mạnh hay yếu của chất khử. Cùng tìm hiểu tính oxi hóa của axit nitric thông qua 3 phản ứng:
Một là,Tác dụng với kim loại
Hai là, Tác dụng với phi kim
Ba là, Tác dụng với hợp chất
Tác dụng với kim loại
Axit nitric có khả năng oxi hóa hầu hết các kim loại tạo ra muối nitrat, ngay cả kim loại có tính khử yếu (Cu, Ag)…, ngoại trừ Pt và Au. Lúc này, kim loại bị oxi hóa đến mức cao nhất. Sản phẩm của phản ứng này sẽ là NO2(+4) đối với HNO3 đặc và NO(+2) đối với HNO3 loãng. Nhôm, sắt và crom thụ động với axit nitric đặc nguội vì lớp màng oxit bền được tạo ra bảo vệ chúng không bị oxy hóa tiếp. Đây cũng là lý do bình nhôm hoặc sắt được dùng để đựng HNO3 đặc.
Phương trình phản ứng:
Kim loại + HNO3 đặc → muối nitrat + NO + H2O (nhiệt độ)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
Ví dụ:
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2(↑) + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO (↑) + 4H2O
Tác dụng với phi kim
Khi được đun nóng, HNO3 đặc có khả năng oxi hóa được các phi kim như S, C, P… (các nguyên tố á kim, ngoại trừ halogen và silic). Sản phẩm tạo thành là nito dioxit (nếu là axit nitric đặc) và oxit nito (với axit loãng và nước).
Ví dụ:
S + 6HNO3 đặc → H2SO4 + 6NO2(↑) + 2H2O (nhiệt độ)
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
Tác dụng với hợp chất
Là một trong những axit cực mạnh, axit nitric (HNO3) đặc có khả năng oxi hóa – phá hủy nhiều hợp chất vô cơ, hữu cơ khác nhau.. Vải, giấy, mùn cưa,… đều bị phá hủy hoặc bốc cháy khi tiếp xúc với HNO3 đặc. Vì vậy, sẽ vô cùng nguy hiểm nếu để axit nitric (HNO3) tiếp xúc với cơ thể người.
Ví dụ:
3H2S + 2HNO3 (>5%) → 3S (↓) + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4(↓) + 8NO2 + 4H2O
HNO3 hòa tan Ag3PO4, không tác dụng với HgS.
7. Cách thực hiện phản ứng
- Cho HNO3 (axit nitric) tác dụng Zn (kẽm)
8. Bạn có biết
- Hiện tại chúng tôi không có thêm bất kỳ thông tin nào thêm về phương trình này.
9. Bài tập liên quan
Câu 1. Cho hỗn hợp gồm AlCl3 và ZnCl2 tác dụng với dung dịch NH3 dư thu được kết tủa X. Lọc lấy X rồi đem nung thu được chất rắn Y. Cho khí H2 dư đi qua Y nung nóng thu được chất rắn gồm
A. Al và Zn
B. Al2O3
C. Al và ZnO
D. Al2O3 và Zn
Lời giải:
AlCl3 + 3NH3 + 6H2O → Al(OH)3 + 3NH4Cl
ZnCl2 + 2NH3 + 2H2O → Zn(OH)2 + 2NH4Cl
Zn(OH)2+ NH3 dư → [Zn(NH3)6](OH)2
Câu 2. Cho phương trình hóa học: Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O
Tổng hệ số của phương trình là
A. 22.
B. 24.
C. 25.
D. 26.
Lời giải:
Câu 3. Hoà tan hết hỗn hợp X gồm Zn và ZnO trong dung dịch HNO3 loãng dư thấy không có khí bay ra và trong dung dịch chứa 113,4 gam Zn(NO3)2 và 8 gam NH4NO3. Phần trăm khối lượng Zn trong X là
A. 33,33%
B. 66,67%
C. 61,61%
D. 50,00%
Lời giải:
nZn(NO3)2 = 0,6 mol; nNH4NO3 = 0,1 mol
ZnO tác dụng với HNO3 không sinh ra sản phẩm khử vì đã đạt số oxi hóa tối đa
Bảo toàn e: 2.nZn = 8.nNH4NO3 => nZn = 4.0,1 = 0,4 mol
Bảo toàn nguyên tố Zn: nZn(NO3)2 = nZn + nZnO => nZnO = 0,6 – 0,4 = 0,2 mol
%mZn = .100%=61,61%
Đáp án cần chọn là: C
Câu 4. Hòa tan hoàn toàn 13,00 gam Zn trong dung dịch HNO3 loãng, dư thu được dung dịch X và 0,448 lít khí X duy nhất (đktc). Cô cạn dung dịch X thu được 39,8 gam chất rắn. Khí X là:
A. NO2
B. N2
C. N2O
D. NO
Lời giải:
Chất rắn khan thu được chứa Zn(NO3)2 và có thể có NH4NO3.
Ta có: nZn(NO3)2 = nZn = 0,2 mol
Giả sử 1 phân tử khí trao đổi n electron.
BT electron: ne cho = n e nhận => 2nZn = 8nNH4NO3 + n.n khí => 2.0,2 = 8.0,025 + n.0,02
=> n = 10 => X là N2
Câu 5. Hợp chất nào sau đây được dùng trong y học để làm thuốc giảm đau dây thần kinh và chữa bệnh eczema?
A. ZnO
B. FeO
C. CuO
D. NiO
Lời giải:
Câu 6. Cho m gam bột Zn vào 500 ml dung dịch Fe2(SO4)3 0,24M. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng dung dịch tăng thêm 9,6 gam so với khối lượng dung dịch ban đầu. Giá trị của m là
A. 29,25.
B. 48,75.
C. 32,50.
D. 20,80.
Lời giải:
nFe2(SO4)3 = 0,24.0,5 = 0,12mol
nFe3+= 0,24 mol
Zn + 2Fe3+ → Zn2+ + 2Fe2+
0,12….0,24…………….0,24
Zn + Fe2+ → Zn2+ + Fe
x……………………x
→ mdd tăng = mZn- mFe= 65.(0,12 + x) – 56x = 9,6 → x = 0,2
=> nZn ban đầu = 0,12 + 0,2 = 0,23 mol
=> mZn = 0,32.65 = 20,8 gam
Câu 7. Tiến hành các thí nghiệm sau:
(1) Cho Zn vào dung dịch Fe2(SO4)3 dư.
(2) Cho bột Mg vào lượng dư dung dịch HCl.
(3) Dẫn khí H2 dư qua ống sứ chứa bột Fe2O3 nung nóng.
(4) Cho Ca vào lượng dư dung dịch CuSO4.
(5) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
Sau khi kết thúc các phản ứng, số thí nghiệm thu được kim loại là
A. 4
B. 2
C. 3
D. 1
Lời giải:
(1) Zn + Fe2(SO4)3dư → ZnSO4 + 2FeSO4 => không thu được kim loại
(2) Mg + 2HCl dư → MgCl2 + H2 => không thu được kim loại
(3) H2dư + Fe2O3 → Fe + H2O => thu được kim loại Cu
(4) Ca + 2H2O → Ca(OH)2+ H2
CuSO4+ Ca(OH)2 → Cu(OH)2 + CaSO4
=> không thu được kim loại
(5) Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag => thu được kim loại Ag
Vậy có 2 thí nghiệm thu được kim loại sau phản ứng là (3) và (5)
Câu 8. Để khử hoàn toàn hỗn hợp FeO và ZnO thành kim loại cần 4,48 lít H2 (đktc). Nếu đem hỗn hợp kim loại thu được hòa tan hoàn toàn bằng dung dịch HCl thì thể tích H2 (đktc) thu được là:
A. 4,48 lít
B. 2,24 lít
C. 3,36 lít
D. 1,12 lít
Lời giải:
nhh oxit = nH2 = nhh kim loại = 0,2 mol
Khi hoà tan hỗn hợp kim loại cùng hóa trị II vào axit thì:
nH2 = nhh kim loại = 0,2 mol
VH2 = 22,4.0,2 = 4,48 lít
Câu 9. Cho m gam hỗn hợp hai kim loại Fe, Zn tác dụng hết với 200 ml dung dịch HCl 1,6M thoát ra 3,36 lít (đktc) khí H2. Dung dịch thu được có giá trị pH là (bỏ qua các quá trình thuỷ phân của muối)
A. 2.
B. 7.
C. 4.
D. 1.
Lời giải:
nkhí = 0,15 mol → nHCl pư = 2.nkhí = 0,3 mol
nHCl dư = 0,2.1,6 – 0,3 = 0,02 mol
→ CM (HCl dư) = = 0,1M → pH = 1.
Câu 10. Cho 500ml dung dịch NaOH 1M tác dụng với 200 ml dung dịch ZnSO4 1M, sau phản ứng thu được a gam kết tủa . Giá trị của a là
A. 9,425.
B. 8,425.
C. 7,425.
D. 14,855
Lời giải:
nOH- = nNaOH= 0,5.1 = 0,5 mol
nZn2+ = nZnCl2 = 0,2.1 = 0,2 mol
Phương trình hóa học:
2NaOH + ZnSO4 → Zn(OH)2↓ + Na2SO4 (1)
(0,5) (0,2) (0,2 mol)
NaOH dư 0,1 mol, tiếp tục có phản ứng:
2NaOH + Zn(OH)2 → Na2[Zn(OH)4] (2)
(0,1) (0,1 mol)
Sau phản ứng (1) và (2) n↓ = 0,2 – 0,05 = 0,15 mol
→ m↓ = a = 0,15.99 = 14,85 g
Câu 11. Cho V lít dung dịch NaOH 2M vào 500ml dung dịch ZnCl2 0,4M, sau phản ứng thu được 9,9 gam kết tủa. Giá trị của V là
A. 0,1 hoặc 0,3.
B. 0,1.
C. 0,05.
D. 0,05 và 0,15.
Lời giải:
nOH- = nNaOH = 2V mol
nZn2+ = nZnCl2 = 0,5. 0,4 = 0,2 mol
n↓ = 9,9/99 = 0,1 mol
Phương trình hóa học
2NaOH + ZnCl2 → Zn(OH)2↓ + 2NaCl (1)
2NaOH + Zn(OH)2 → Na2[Zn(OH)4] (2)
Ta có: n↓ = 0,1 < nZn2+ → Có 2 trường hợp xảy ra
Trường hợp 1: NaOH hết; ZnCl2 dư
Theo (1) → nOH- = 2n↓ = 0,2 mol
→ V = 0,2 : 2 = 0,1 lít
Câu 12. Cho một lượng bột Zn vào dung dịch X gồm FeCl2 và CuCl2. Khối lượng chất rắn sau khi các phản ứng xảy ra hoàn toàn nhỏ hơn khối lượng bột Zn ban đầu là 0,5 gam. Cô cạn phần dung dịch sau phản ứng thu được 13,6 gam muối khan. Tổng khối lượng các muối trong X là
A.13,1 gam.
B.17,0 gam.
C.19,5 gam.
D.14,1 gam.
Lời giải:
mdd tăng = mrắn giảm = 0,5 gam → mdd ban đầu = 13,6 – 0,5 = 13,1 gam
Câu 13. Cho 5,62 gam hỗn hợp gồm 3 oxit Fe2O3, MgO, ZnO tan vừa đủ trong 600ml dung dịch H2SO4 0,1M thì khối lượng muối sunfat khan tạo thành là:
A. 5,33 gam
B. 5,21 gam
C. 10,42 gam
D. 5,68 gam.
Lời giải:
nH2SO4 = 0,06 (mol)
Áp dụng phương pháp tăng giảm khối lượng:
mmuối = moxit+ 0,06.( 96 - 16) = 5,62 + 0,06.80 = 10,42 gam
Câu 14. Oxi hóa hoàn toàn 30,2 gam hỗn hợp bột các kim loại Cu, Zn, Al bằng oxi thu được 44,6 gam hỗn hợp các oxit. Cho lượng oxit này tan trong dung dịch HCl. Khối lượng muối khan thu được là:
A. 47,05
B. 63,90
C. 94,10
D. 37,30
Lời giải:
mO(oxit) = moxit – m kim loại = 44,6 - 30,2 = 14,4 gam
nO(oxit) = 0,9 mol => nCl-= 2.0,9 = 1,8 mol
mmuối= mkim loại+ mCl-= 30,2 + 1,8.35,3 = 94,1 gam
Câu 15. Chất oxi hoá là chất
A. cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Lời giải:
Câu 16. Cho các phản ứng oxi hoá- khử sau:
3I2 + 3H2O → HIO3 + 5HI (1)
HgO → 2Hg + O2 (2)
4K2SO3 → 3K2SO4 + K2S (3)
NH4NO3 → N2O + 2H2O (4)
2KClO3 → 2KCl + 3O2 (5)
3NO2 + H2O → 2HNO3 + NO (6)
4HClO4 → 2Cl2 + 7O2 + 2H2O (7)
2H2O2 → 2H2O + O2 (8)
Cl2 + Ca(OH)2 → CaOCl2 + H2O (9)
KMnO4 → K2MnO4 + MnO2 + O2 (10)
Trong số các phản ứng oxi hoá- khử trên, số phản ứng oxi hoá- khử nội phân tử là
A. 2.
B. 3.
C. 4.
D. 5.
Lời giải:
10. Một số phương trình phản ứng hoá học khác của Kẽm (Zn) và hợp chất:
Zn + HNO3 → Zn(NO3)2 + NH4NO3 + H2O