Tailieumoi.vn giới thiệu Giải sách bài tập Hóa học lớp 8 Bài 29: Luyện tập chương 4 chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 8. Mời các bạn đón xem:
Giải SBT Hóa học 8 Bài 29: Luyện tập chương 4
Bài 29.1 trang 40 SBT Hóa học 8: Hãy chọn những từ, cụm từ và công thức hoá học thích hợp để điền vào những chỗ trống trong câu sau :
Oxi có thể điều chế trong phòng thí nghiệm bằng phản ứng nhiệt phân .......... Người ta thu khí này bằng cách đẩy ............ trong ống nghiệm vì không tác dụng với ............ Ống nghiệm phải đặt ở tư thế ............
Phương pháp giải:
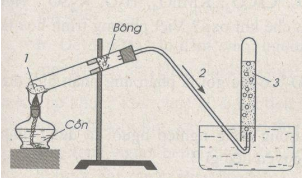
Lời giải:
Oxi có thể điều chế trong phòng thí nghiệm bằng phản ứng nhiệt phân ( hoặc ) Người ta thu khí này bằng cách đẩy nước trong ống nghiệm vì không tác dụng với nước và tan ít trong nước. Ống nghiệm phải đặt ở tư thế úp ngược miệng ống vào chậu nước.
Bài 29.2 trang 40 SBT Hóa học 8: Để sản xuất vôi, trong lò vôi người ta thường sắp xếp một lớp than, một lớp đá vôi, sau đó đốt lò. Có những phản ứng hoá học nào xảy ra trong lò vôi ?
Phản ứng nào là phản ứng phân huỷ ; Phản ứng nào là phản ứng hoá hợp ?
Phương pháp giải:
) Viết PTHH
+) Phản ứng hóa hợp là phản ứng hóa học trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
+) Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
Lời giải:
Những phản ứng hóa học xảy ra trong lò vôi là :
: phản ứng tỏa nhiệt - phản ứng hóa hợp
: phản ứng thu nhiệt - phản ứng phân hủy
Bài 29.3 trang 40 SBT Hóa học 8: Hoàn thành những phương trình hóa học sau:
a)
b)
c)
d)
e)
Cho biết mỗi phản ứng hóa học trên thuộc loại phản ứng hóa học nào
Phương pháp giải:
+) Học sinh tự viết PTHH
+) Phản ứng hóa hợp là phản ứng hóa học trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
+) Phản ứng phân hủy là phản ứng hóa học trong đó một chất sinh ra hai hay nhiều chất mới.
Lời giải:
a)
b)
c)
d)
e)
Phản ứng hóa hợp :a, b, c
Phản ứng phân hủy : d, e
Bài 29.4 trang 40 SBT Hóa học 8: Bình đựng ga dùng để đun nấu trong gia đình có chứa 12,5 kg butan ( C4H10 )ở trạng thái lỏng, do được nén dưới áp suất cao.
a) Tính thể tích không khí cần dùng ở đktc để đốt cháy hết lượng nhiên liệu có trong bình (biết oxi chiếm khoảng 20% thể tích không khí, phản ứng cháy của butan cho CO2 và H2O)
b) Thể tích CO2 (đktc) sinh ra là bao nhiêu ? Để không khí trong phòng được thoáng ta phải làm gì ?
Phương pháp giải:
+) Tính số mol butan
+) PTHH:
Tính theo PTHH => số mol O2 và số mol CO2
a) Số mol không khí = 5 lần số mol O2 => thể tích không khí cần dùng.
b) Từ số mol CO2 => thể tích CO2
Lời giải:
Phương trình hóa học:
2 mol 13 mol 8 mol
215,5mol x mol y mol
a)
b)
Để không khí trong phòng được thoáng ta cần có máy hút gió trên bếp hoặc mở các của trong bếp ăn.
Bài 29.5 trang 41 SBT Hóa học 8: Khi nung nóng kali clorat KClO3 (có chất xúc tác), chất này bị phân huỷ tạo thành kali clorua và khí oxi.
Tính khối lượng kali clorat cần thiết để sinh ra một lượng oxi đủ đốt cháy hết 3,6 g cacbon.
Phương pháp giải:
+) Tính số mol cacbon
+) PTHH: (1)
(2)
Tính theo PTHH (1)=> số mol oxi
Tinh theo PTHH (2) => số mol kali clorat => khối lượng kali clorat cần dùng.
Lời giải:
Số mol cacbon
Phương trình hóa học:
(1)
1 mol 1 mol
Số mol khí oxi cần có là :
(2)
2 mol 3 mol
x mol 0,3 mol
Khối lượng cần dùng là:
Bài 29.6 trang 41 SBT Hóa học 8: Đốt cháy 6,2 g photpho trong bình chứa 7,84 lít oxi (đktc). Hãy cho biết sau khi cháy :
a) Photpho hay oxi, chất nào còn thừa và khối lượng là bao nhiêu.
b) Chất nào được tạo thành và khối lượng là bao nhiêu.
Phương pháp giải:
+) Tính số mol photpho và oxi
+) PTHH:
a) Tính theo PTHH => khối lượng chất dư
b) Tính theo PTHH => khối lượng chất tạo thành
Lời giải:
a) ;
Phương trình hóa học :
4 mol 5 mol 2 mol
0,2mol 0,25mol x mol
a) Oxi dư : 0,35 - 0,25 =0,1 (mol). Khối lượng khí oxi dư: 32 x 0,1 = 32(g)
b) Số mol được tạo thành:
Bài 29.7 trang 41 SBT Hóa học 8: Xác định công thức hoá học một oxit của lưu huỳnh có khối lượng mol là 64 g/mol và biết thành phần phần trăm về khối lượng của nguyên tố lưu huỳnh trong oxit là 50%.
Phương pháp giải:
+) Gọi công thức có dạng
Cách 1: Tính số mol nguyên tử S và O trong 1 mol hợp chất => Công thức.
Cách 2: Dựa theo phần trăm khối lượng ta có:
== => x, y => Công thức cần tìm.
Lời giải:
Giả sử công thức hóa học của oxit có dạng
Cách 1: - Trong 1 mol oxit của lưu huỳnh có 32 g S và 32 g O.
- Số mol nguyên tử S và O trong 1 mol hợp chất:
Suy ra trong 1 phân tử hợp chất có 1 nguyên tử S và 2 nguyên tử O.
- Công thức hóa học của hợp chất :
Cách 2:
Theo giả thiết ta có :
==
Công thức hóa học của oxit : .
Bài 29.8 trang 41 SBT Hóa học 8: Một oxit của photpho có thành phần phần trăm khối lượng của P bằng 43,66%. Biết phân tử khối của oxit bằng 142 đvC. Công thức hoá học của oxit là
A. B.
C. D.
Phương pháp giải:
Cách 1: Tìm số mol nguyên tử P và O trong 1 mol hợp chất => Công thức của oxit.
Cách 2: Gọi công thức hóa học của oxit photpho là
Lập tỉ lệ khối lượng:
=> x
=> y
=> Công thức của oxit.
Lời giải:
Cách 1: - Tìm và trong 1 mol hợp chất:
.
-Tìm số mol nguyên tử P và O trong 1 mol hợp chất :
.
Suy ra trong 1 phân tử hợp chất có 2 nguyên tử P và 5 nguyên tử O. Công thức hóa học của hợp chất là : .
Cách 2: Gọi công thức hóa học của oxit photpho là .
Lập các tỷ số khối lượng:
Công thức hóa học của oxit photpho là
=> Chọn B.
Bài 29.9 trang 41 SBT Hóa học 8: Trong phòng thí nghiệm, khi đốt cháy sắt trong oxi ở nhiệt độ cao thu được oxit sắt từ (Fe3O4).
a) Số gam sắt và khí oxi cần dùng để điều chế 2,32 g oxit sắt từ lần lượt là
A. 0,84 g và 0,32 g. B.2,52 g và 0,96 g.
C. 1,68 g và 0,64 g. D. 0,95 g và 0,74 g.
b) Số gam kali pemanganat KMnO4 cần dùng để điều chế lượng khí oxi dùng cho phản ứng trên là
A.3,16 g. B. 9,48 g. C. 5,24 g D. 6,32 g.
Phương pháp giải:
a) +) PTHH:
+) Tính
+) Tính theo PTHH =>
+) Áp dụng ĐLBTKL => = -
b) PTHH:
Tính theo PTHH =>
Lời giải:
a)
Phương trình hóa học điều chế :
0,03 mol 0,01 mol
Theo định luật bảo toàn khối lượng:
=> Chọn C.
b) Phương án D.
Phương trình phân hủy
0,04 mol 0,02 mol
Bài 29.10 trang 41 SBT Hóa học 8: Một oxit được tạo bởi 2 nguyên tố sắt và oxi trong đó tỉ lệ khối lượng giữa sắt và oxi là 7/3. Tìm công thức phân tử của oxit đó.
Phương pháp giải:
+) Gọi công thức oxit sắt là
+) Theo đề bài ta có:
+) Từ phương trình trên rút ra tỉ lệ nguyên tối giản x : y => Công thức oxit
Lời giải:
Theo đề bài, ta có :
Gọi công thức oxit sắt là :
Rút ra:
Công thức hóa học của oxit là
Bài 29.11 trang 41 SBT Hóa học 8: Tính khối lượng khí cacbonic sinh ra trong mỗi trường hợp sau :
a) Khi đốt 0,3 mol cacbon trong bình chứa 4,48 lít khí oxi (đktc).
b) Khi đốt 6 g cacbon trong bình chứa 13,44 lít khí oxi (đktc).
Phương pháp giải:
a) Viết phương trình hoá học của phản ứng đốt cháy cacbon trong oxi. Dựa vào phương trình hoá học và số liệu đề bài cho xem chất nào dư, chất nào tác dụng hết, tính khối lượng khí CO2 theo chất tác dụng hết.
b) Tương tự phần a.
Lời giải:
a)
Cacbon dư sau phản ứng,
b)
1 mol 1 mol 1 mol
0,5 0,6
Tỷ lệ số mol O2 dư, C hết
Bài 29.12 trang 42 SBT Hóa học 8: Nung a gam KClO3 và b gam KMnO4 thu được cùng một lượng O2. Tính tỉ lệ a/b.
Phương pháp giải:
+) PTHH:
+) Biểu diễn số mol O2 theo a và b từ đó rút ra tỉ lệ a/b
Lời giải:
2 mol 3 mol
2 mol 1 mol
Muốn được cùng một lượng oxi: =
Rút ra tỷ lệ:
Bài 29.13 trang 42 SBT Hóa học 8: Cho 5 g photpho vào bình có dung tích 2,8 lít chứa không khí (ở đktc), rồi đốt cháy hoàn toàn lượng photpho trên thu được m gam điphotpho pentaoxit . Cho biết oxi chiếm 20% thể tích không khí, hiệu suất phản ứng đạt 80%. Tính m.
Phương pháp giải:
+) Tính số mol oxi, số mol photpho.
+) PTHH:
Dựa vào phương trình hoá học và số liệu đề bài cho xem chất nào dư, chất nào tác dụng hết, tính khối lượng theo chất tác dụng hết.
+) Sử dụng công thức tính hiệu suất:
Lời giải:
Phương trình hóa học của phản ứng:
Theo pt : 4 mol 5 mol 2 mol
Theo đb: 0,16 mol 0,025 mol
Ta có tỷ lệ: dư P nên tính khối lượng theo
Khối lượng thực tế thu được :
Bài 29.14 trang 42 SBT Hóa học 8: Đốt cháy hoàn toàn 3,52 g hợp chất X, thu được 3,2 g sắt(III) oxit và 0,896 lít khí sunfurơ (đktc). Xác định công thức phân tử của X, biết khối lượng mol của X là 88 g/mol.
Phương pháp giải:
Tìm các nguyên tố có trong X:
Tính mFe, mS
So sánh (mFe+ mS ) với m hợp chất để kết luận trong X có oxi hay không?
Gọi công thức của hợp chất cần tìm
Lập tỉ lệ về số mol của các nguyên tố => Công thức cần tìm
Lời giải:
Cách 1:
Khi đốt cháy X thu được Fe2O3 và SO2 nên trong X có Fe, S và có thể có O
Ta có: mFe(X) + mS(X) = 2,24 + 1,28 = 3,52 = mX
Vậy trong X không có O
Đặt công thức phân tử hợp chất X có dạng
Ta có tỷ lệ:
Công thức phân tử hợp chất X có dạng
Công thức phân tử của X là FeS
Cách 2: Sau khi tính được khối lượng sắt, khối lượng lưu huỳnh, ta có thể tính theo cách sau:
Công thức phân tử của X là FeS
Bài 29.15 trang 42 SBT Hóa học 8: Thêm 3,0 g MnO2 vào 197 g hỗn hợp muối KCl và KClO3. Trộn kĩ và đun nóng hỗn hợp đến phản ứng hoàn toàn, thu được chất rắn nặng 152 g. Hãy xác định thành phần phần trăm khối lượng của các chất trong hỗn hợp muổi đã dùng.
Phương pháp giải:
+) PTHH:
+) Áp dụng ĐLBTKL=> Khối lượng oxi thoát ra.
+) Dựa vào PTHH => số mol KCl và KClO3
+) Tính khối lượng KCl và KClO3=> Phần trăm tương ứng.
Lời giải:
Khối lượng oxi thoát ra: 197 + 3 - 152 = 48(g)
Số mol = 1,5(mol)
Phương trình hóa học của phản ứng :
2 mol 3 mol
= 1mol 1,5 mol
Khối lượng trong hỗn hợp : 1 x 122,5 =122,5 (g)
Khối lượng KCl trong hỗn hợp ban đầu: 197 - 122,5 = 74,5(g)
Bài 29.16 trang 42 SBT Hóa học 8: Nhiệt phân 15,8 g KMnO4 thu được lượng khí O2, đốt cháy 5,6 g Fe trong lượng khí O2 vừa thu được thì sản phẩm sau phản ứng có bị cục nam châm hút không ? Hãy giải thích.
Phương pháp giải:
) Tính ;
+) PTHH:
Dựa vào PTHH => tính số mol oxi theo KMnO4
+) PTHH:
+) Lập tỉ lệ để tìm chất dư sau phản ứng => Kết luận Fe còn dư hay không
Lời giải:
Phương trình hóa học của phản ứng:
2 mol 1 mol
0,1 mol 0,05 mol
3 mol 2 mol
Lập tỷ số:. Vậy Fe còn dư nên sản phẩm sau phản ứng bị nam châm hút
Bài 29.17 trang 42 SBT Hóa học 8: Cho m gam hỗn hợp 2 kim loại Mg và Al có số mol bằng nhau phản ứng hoàn toàn với lượng oxi dư. Kết thúc phản ứng thu được hỗn hợp chất rắn có khối lượng tăng so với hỗn hợp ban đầu là 2 g. Tính m.
Phương pháp giải:
+) Gọi số mol của Mg và Al là x (mol)
+) PTHH:
+) Khối lượng chất rắn tăng = khối lượng oxi tham gia phản ứng
+) Theo đề bài ta lập pt ẩn x. Giải pt => x => m.
Lời giải:
Phương trình hóa học của phản ứng :
x mol 0,5x mol
x mol mol
Khối lượng chất rắn tăng = khối lượng oxi tham gia phản ứng =2 g
Theo phương trình (1) ,(2) và đề bài, ta có :
m = 0,05 (24+27) = 2,55 (g)
Bài 29.18 trang 42 SBT Hóa học 8: Đốt 4,6 g Na trong bình chứa 2240 ml O2 (ở đktc). Nếu sản phẩm sau phản ứng cho tác dụng với H2O thì có H2 bay ra không ? Nếu cho giấy quỳ tím vào dung dịch sau phản ứng thì quỳ tím có đổi màu không ?
Phương pháp giải:
+) Tính số mol các chất tham gia phản ứng.
+) PTHH:
+) Dựa vào phương trình hoá học và số liệu đề bài cho xem chất nào dư, chất nào tác dụng hết. Từ đó kết luận hiện tượng khi cho giấy quì vào dung dịch sau phản ứng.
Lời giải:
Phương trình hóa học của phản ứng :
4 mol 1 mol 2 mol
Lập tỷ số: = 0,05 < Vậy dư, sau phản ứng không còn Na dư nên không có khí hidro bay ra, quỳ tím chuyển thành màu xanh do:
Bài 29.19 trang 42 SBT Hóa học 8: Đốt cháy hoàn toàn a lít khí hiđrocacbon CxHy, thu được 6,72 lít khí CO2 và 7,2 g H2O. Tìm công thức phân tử hiđrocacbon, biết hiđrocacbon này có tỉ khối so với heli bằng 11, các khí được đo ở đktc.
Phương pháp giải:
+) Tính số mol CO2 và H2O
+) PTHH:
+) Lập tỉ lệ:
+) Gọi công thức đơn giản nhất của hợp chất là: biện luận n theo M => CTPT của hidrocacbon.
Lời giải:
Phương trình hóa học của phản ứng:
Theo phương trình:
Công thức phân tử của hidrocacbon có dạng có M = 44 (g/mol).
Vậy 44n = 44 n=1. Công thức phân tử của hiđrocacbon là
Bài 29.20 trang 42 SBT Hóa học 8: Trong quá trình quang hợp, cây cối trên mỗi hecta đất trong một ngày hấp thụ khoảng 100 kg khí cacbonic và sau khi đồng hoá cây cối nhả ra khí oxi. Hãy tính khối lượng khí oxi do cây cối trên 5 hecta đất trồng sinh ra mỗi ngày. Biết rằng số mol khí oxi cây sinh ra bằng số mol khí cacbonic hấp thụ.
Phương pháp giải:
+) Tính trên mỗi hecta.
+) Ta có => Khối lượng oxi sinh ra trên 5 hecta.
Lời giải:
Đổi 100kg=100000g
sinh ra trên mỗi hecta trong mỗi ngày.
Khối lượng khí sinh ra trên 5 hecta trong 1 ngày là: