Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 12 Bài 27: Nhôm và hợp chất của nhôm chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Nhôm và hợp chất của nhôm lớp 12.
Bài giảng Hóa học 12 Bài 27: Nhôm và hợp chất của nhôm
Giải bài tập Hóa học 12 Bài 27: Nhôm và hợp chất của nhôm
Câu hỏi và bài tập (trang 128,129 SGK Hóa Học 12)
Bài 1 trang 128 SGK Hóa Học 12: Viết phương trình hóa học của mỗi phản ứng thực hiện dãy chuyển đổi sau
Lời giải:
(1) 2Al + 3Cl2 2AlCl3
(2) AlCl3 + 3NaOH đủ → Al(OH)3↓ + 3NaCl
(3) Al(OH)3 + NaOH → NaAlO2 + 2H2O
(4) NaAlO2 + CO2 + 2H2O → Al(OH)3↓ + NaHCO3
(5) 2Al(OH)3 Al2O3 + 3H2O
(6) 2Al2O3 4Al + 3O2↑
Bài 2 trang 128 SGK Hóa Học 12: Có 2 lọ không ghi nhãn đựng dung dịch AlCl3 và dung dịch NaOH. Không dùng thêm chất nào khác, làm thế nào để nhận biết mỗi chất?
Phương pháp giải:
Dựa vào thí nghiệm cho từ từ AlCl3 vào dung dịch NaOH và ngược lại
=> hiện tượng quan sát được khác nhau
=> nhận biết được mỗi chất
Lời giải:
Lấy mỗi chất 1 ít cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng.
- Lấy dung dịch ở lọ thứ nhất nhỏ dần dần vào lọ thứ hai nếu ban đầu không có kết tủa, sau một thời gian thấy có kết tủa, kết tủa tăng dần thì lọ thứ nhất đựng dung dịch AlCl3 còn lọ thứ hai đựng dung dịch NaOH. Ngược lại, nếu thấy mới đầu kết tủa, sau đó kết tủa tan dần thì lọ thứ nhất đựng dung dịch NaOH, lọ thứ hai đựng dung dịch AlCl3.
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3↓ + NaOH → NaAlO2 + 2H2O
Bài 3 trang 128 SGK Hóa Học 12: Phát biểu nào sau đây là đúng?
A. Nhôm là 1 kim loại lưỡng tính.
B. Al(OH)3 là một bazơ lưỡng tính.
C. Al2O3 là một oxit trung tính.
D. Al(OH)3 là một hiđroxit lưỡng tính.
Lời giải:
A. Sai vì Al tác dụng với cả dung dịch axit và dung dịch bazơ nhưng không được gọi là kim loại lưỡng tính
B. Sai vì không có khái niệm bazơ lưỡng tính
C. Sai vì Al2O3 là một oxit lưỡng tính
D. Đúng
Bài 4 trang 128 SGK Hóa Học 12: Trong những chất sau, chất nào không có tính lưỡng tính?
A. Al(OH)3; B. Al2O3;
C. ZnSO4; D. NaHCO3.
Lời giải:
Al(OH)3; Al2O3; NaHCO3 đều là chất lưỡng tính vì chúng đều tác dụng với dung dịch axit và dung dịch bazơ.
Đáp án C.
Bài 5 trang 129 SGK Hóa Học 12: Cho một lượng hỗn hợp Mg – Al tác dụng với dung dịch HCl dư thu được 8,96 lít H2. Mặt khác, cho lượng hỗn hợp như trên tác dụng với dung dịch NaOH dư thì thu được 6,72 lít H2. Các thể tích khí đều đo ở đktc.
Tính khối lượng của mỗi kim loại có trong lượng hỗn hợp đã dùng.
Phương pháp giải:
Viết PTHH xảy ra, tính toán theo PTHH
Mg + 2HCl → MgCl2 + H2 ↑ (1)
2Al + 6HCl → 2AlCl3 + 3H2 ↑ (2)
Cho hỗn hợp tác dụng với dung dịch NaOH dư chỉ có Al phản ứng
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ (3)
Lời giải:
Cách 1:
2Al + 6HCl → 2AlCl3 + 3H2 ↑ (1)
0,2 0,3 (mol)
Mg + 2HCl → MgCl2 + H2 ↑ (2)
0,1 0,1 (mol)
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑ (3)
0,2 0,3 (mol)
nH2 ở (1) và (2) = 8,96 : 22,4 = 0,4 (mol); nH2 ở (3) = 6,72 : 22,4 = 0,3 (mol)
nH2 ở (1) =nH2 ở (3) = 0,3 (mol)
=> nH2 ở (2) = 0,4 - 0,3 = 0,1 (mol)
=> mMg = 24.0,1 = 2,4 (gam); mAl = 27.0,2 = 5,4 (gam).
Cách 2:
Gọi x và y lần lượt là số mol Mg và Al trong hỗn hợp
PTHH:
Mg + 2HCl MgCl2 + H2
x x (mol)
2Al + 6HCl 2AlCl3 + 3H2
y (mol)
2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2
y (mol)
Số mol H2
Theo bài ra ta có hệ phương trình:
mMg = 24.0,1 = 2,4 gam
mAl = 27.0,2 = 5,4 gam
Bài 6 trang 129 SGK Hóa Học 12: Cho 100 ml dung dịch AlCl3 1M tác dụng với 200 ml dung dịch NaOH. Kết tủa tạo thành được làm khô và nung đến khối lượng không đổi cân nặng 2,55 gam. Tính nồng độ mol của dung dịch NaOH ban đầu.
Phương pháp giải:
Đổi số mol của AlCl3 ; Al2O3
Viết PTHH xảy ra
TH1 : NaOH thiếu.
AlCl3 + 3NaOH → Al(OH)3 ↓ + 3NaCl
2Al(OH)3 Al2O3 + 3H2O
TH2 : NaOH dư, lượng kết tủa sinh ra đã bị hòa tan 1 phần
AlCl3 + 3NaOH → Al(OH)3 ↓ + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
2Al(OH)3 Al2O3 + 3H2O
Đặt số mol vào mỗi phương trình và tính toán theo phương trình => kết quả.
Lời giải:
nAlCl3 = 0,1.1 = 0,1 (mol); nAl2O3 = = 0,025 (mol)
Có hai trường hợp:
TH1:NaOH thiếu.
AlCl3 + 3NaOH → Al(OH)3 ↓ + 3NaCl (1)
0,05.3 0,05 (mol)
2Al(OH)3 Al2O3 + 3H2O (2)
0,05 0,025 (mol)
=>CM (NaOH) = = 0,75 (M).
b) NaOH dư , nên hòa tan một phần lượng kết tủa
AlCl3 + 3NaOH → Al(OH)3 ↓ + 3NaCl (1)
0,1 0,3 0,1 (mol)
Al(OH)3 + NaOH → NaAlO2 + 2H2O (2)
0,05 0,05 (mol)
2Al(OH)3 Al2O3 + 3H2O (3)
0,05 0,025 (mol)
=> nNaOH = 0,3 + 0,05 = 0,35 (mol); CM (NaOH) = = 1,75 (M).
Bài 7 trang 129 SGK Hóa Học 12: Có 4 mẫu kim loại là Na, Al, Ca, Fe. Chỉ dùng nước làm thuốc thử thì số kim loại có thể phân biệt được tối đa là bao nhiêu?
A. 1. B. 2.
C. 3. D. 4.
Lời giải:
Chỉ dùng nước, có thể nhận biết được cả 4 kim loại.
Cho 4 kim loại vào nước:
-Kim loại phản ứng mạnh, giải phóng chất khí, dung dịch thu được trong suốt là Na.
2Na + 2H2O→ 2NaOH + H2↑
-Kim loại phản ứng mạnh, giải phóng chất khí, dung dịch thu được vẩn đục là Ca vì tạo ra Ca(OH)2 ít tan.
Ca + H2O → Ca(OH)2 + H2
- Dùng dung dịch NaOH thu được cho tác dụng với 2 kim loại còn lại. Kim loại nào tan được và giải phóng ra khí là Al, kim loại không phản ứng là Fe.
Al + NaOH + H2O → NaAlO2 + 3/2H2↑
Đáp án D
Bài 8 trang 129 SGK Hóa Học 12: Điện phân Al2O3 nóng chảy với dòng điện cường độ 9,56A trong khoảng thời gian 3000 giây, thu được 2,16 gam Al. Hiệu suất của quá trình điện phân là.
A. 60%. B. 70%.
C. 80%. D. 90%.
Phương pháp giải:
Áp dụng định luật Faraday
Với m- khối lượng nhôm thu được ở điện cực
A- Nguyên tử khối của nhôm = 27 g/mol
I - Cường độ dòng điện
t - Thời gian điện phân
n - số electron của nhôm nhường
F - Hằng số Faraday (F = 96500).
Lời giải:
Theo định luật Faraday khối lượng nhôm thu được là:
Hiệu suất phản ứng là:
Đáp án C
Lý thuyết Bài 27: Nhôm và hợp chất của nhômA. NHÔM
I. VÍ TRÍ VÀ CẤU TẠO
- Al: 1s22s22p63s23p1
=> Số hiệu nguyên tử 13, thuộc nhóm IIIA, chu kì 3.
- Trong hợp chất, Al có số OXH bền là +3
- Nhôm có cấu tạo mạng tinh thể lập phương tâm diện
II. TÍNH CHẤT VẬT LÍ
- Nhôm là kim loại nhẹ, màu trắng bạc.
- Nhôm rất dẻo, dẫn điện, dẫn nhiệt rất tốt.
III. TÍNH CHẤT HÓA HỌC
1. Tác dụng với phi kim
- Với oxi: Ở to thường tạo lớp màng oxit bảo vệ. Nếu đốt bột nhôm thì sẽ phản ứng mạnh.
4Al + 3O2 2Al2O3
- Với phi kim khác:
+ Với Cl2, Br2 phản ứng ngay ở to thường tạo thành AlCl3, AlBr3 phản ứng bốc cháy.
Ví dụ:
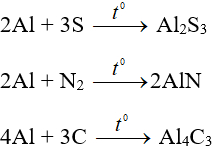
2. Tác dụng với axit
- Al + dung dịch axit (HCl, H2SO4) → muối + H2
2Al + 6H+ → 2Al3+ + 3H2
- Al + dung dịch axit (có tính OXH mạnh) → muối + sản phẩm khử + H2O
4Al + 4HNO3 loãng Al(NO3)3 + NO + 2H2O
2Al + 6H2SO4 đặc Al2(SO4)3 + 3SO2 + 6H2O
- Al không tác dụng với H2SO4, HNO3 đặc nguội.
3. Tác dụng với oxit kim loại
Ở nhiệt độ cao, Al khử được nhiều oxit kim loại như Fe2O3, Cr2O3,... thành kim loại tự do.
2Al + Fe2O3 Al2O3 + 2Fe
4. Tác dụng với dung dịch kiềm
2Al + 2NaOH + 6H2O → 2Na(dd) + 3H2
IV. ỨNG DỤNG VÀ SẢN XUẤT
1. Ứng dụng
- Người ta dùng nhôm để chế tạo vỏ máy bay, tên lửa, tàu vũ trụ do đặc tính nhẹ, bền với không khí và nước
- Làm dây dẫn điện cao áp, đồ nội thất, làm vật trao đổi nhiệt
- Chế tạo hỗn hợp tecmit (Al và Fe2O3) được dùng để hàn gắn đường ray.
2. Sản xuất
Điện phân nóng chảy Al2O3
2Al2O3 4Al + 3O2
B. MỘT SỐ HỢP CHẤT QUAN TRỌNG CỦA NHÔM
I. NHÔM OXIT
Tính chất vật lí : là chất rắn màu trắng, không tan trong nước nóng chảy ở 2050 độ C
Tính chất hóa học : Al2O3 là oxit lưỡng tính, tác dụng được với dung dịch axit và dung dịch kiềm:
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH + 3H2O → 2Na
Ứng dụng :
- Tinh thể Al2O3 (corinđon) được dùng làm đồ trang sức, chế tạo các chi tiết trong các ngành kĩ thuật chính xác, như chân kính đồng hồ, thiết bị phát tia lade,...
- Bột Al2O3 có độ cứng cao được dùng làm vật liệu mài.
- Boxit Al2O3.2H2O là nguyên liệu sản xuất nhôm kim loại.
II. NHÔM HIDROXIT
Tính chất vật lí: Là chất kết tủa keo, màu trắng, không tan trong nước, dễ bị nhiệt phân hủy
Tính chất hóa học :
- Dễ bị nhiệt phân thành nhôm oxit :
2Al(OH)3 Al2O3 + 3H2O
- Là hợp chất lưỡng tính, tan trong axit và bazo
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Al(OH)3 + NaOH → Na
Điều chế: Cho muối nhôm phản ứng với dung dịch NH3 hoặc muối Na2CO3 :
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3↓ + 6NaCl + 3CO2↑
III. NHÔM SUNFAT
- Al2(SO4)3: là chất bột màu trắng, bị phân hủy nhiệt trên 770oC
- Phèn chua: K2SO4.Al2(SO4)3.24H2O hoặc : KAl(SO4)2.12H2O tồn tại ở dạng tinh thể có vị hơi chua và chát.
Sơ đồ tư duy: Nhôm và hợp chất của nhôm
Dạng 1: Lý thuyết về kim loại nhôm
Ví dụ 1: Nhôm thể hiện tính chất nào sau đây ?
1) Nhôm có cấu tạo mạng tinh thể lập phương tâm diện.
2) Là kim loại màu trắng bạc, mềm, dễ kéo sợi và dát mỏng.
3) Nhôm dẫn điện và dẫn nhiệt tốt, tốt hơn các kim loại Fe và Cu.
4) Nhôm là kim loại nhẹ, nóng chảy ở nhiệt độ 660oC.
5) Nhôm là nguyên tố s.
A. 1, 2, 4, 5.
B. 1, 2, 4.
C. 1, 3, 4, 5.
D. 1, 2, 3, 4.
Hướng dẫn giải chi tiết:
(3) Nhôm dẫn điện và dẫn nhiệt tốt, tốt hơn các kim loại Fe và Cu.
=> Sai do tính dẫn điện của Cu tốt hơn Al
Đáp án B.
Ví dụ 2: Tính chất nào sau đây của nhôm là đúng ?
A. Nhôm tác dụng với các axit ở tất cả mọi điều kiện.
B. Nhôm tan được trong dung dịch NH3.
C. Nhôm bị thụ động hóa với HNO3 đặc nguội và H2SO4 đặc nguội.
D. Nhôm là kim loại lưỡng tính.
Hướng dẫn giải chi tiết:
Lưu ý: nhôm bị thụ động với HNO3 đặc nguội, và H2SO4 đặc nguội.
Đáp án C
Ví dụ 3: Tính chất nào sau đây của nhôm là đúng ?
A. Nhôm tác dụng với các axit ở tất cả mọi điều kiện.
B. Nhôm tan được trong dung dịch NH3.
C. Nhôm bị thụ động hóa với HNO3 đặc nguội và H2SO4 đặc nguội.
D. Nhôm là kim loại lưỡng tính.
Dạng 2: Nhôm và hợp chất của nhôm tác dụng với dung dịch kiềm
*Một số ví dụ điển hình:
Ví dụ 1: Cho từ từ 350 ml dung dịch NaOH 1M vào 100 ml dung dịch AlCl3 x mol/l, sau khi các phản ứng xảy ra hoàn toàn thu được 3,9 gam kết tủa.Giá trị của x là
Hướng dẫn giải chi tiết:
nNaOH = VNaOH×CM = 0,35×1 = 0,35 (mol) ;
nAlCl3 = 0,1x (mol)
nAl(OH)3 = 3,9 : 78 = 0,05 (mol)
Ta thấy: nAl(OH)3 < 3nNaOH → xảy ra trường hợp tạo kết tủa cực đại, sau đó kết tủa tan 1 phần.
Khi cho từ từ dd NaOH vào dd AlCl3 xảy ra phản ứng theo thứ tự sau:
3NaOH + AlCl3 → Al(OH)3↓ + 3NaCl (1)
0,3x ← 0,1x → 0,1x (mol)
NaOH + Al(OH)3↓ → NaAlO2 + 2H2O (2)
(0,1x – 0,05) ← (0,1x – 0,05) (mol)
Theo PTHH (1): nAl(OH)3 cực đại = nAlCl3 = 0,1x (mol)
→ nAl(OH)3 bị hòa tan = nAl(OH)3 cực đại – nAl(OH)3 còn lại = 0,1x – 0,05 (mol)
Ta có: ∑ nNaOH(1)+(2) = 0,3x + (0,1x – 0,05)
→ 0,4x - 0,05 = 0,35
→ 0,4x = 0,4 → x = 1 (M)
* Ta cũng có thể áp dụng công thức tính nhanh
4 * nAlCl3 - nNaOH = n Al(OH)3
4 * 0,1x - nNaOH = n Al(OH)3
=> 4* 0,1 x = 0,05 + 0,35 => x = 1M
Ví dụ 2: Hỗn hợp X gồm Al và Al2O3. Hòa tan hoàn toàn 1,83 gam X trong 50 ml dung dịch NaOH 1M (vừa đủ), thu được V lít H2 (đktc). Giá trị của V là
Hướng dẫn giải chi tiết:
nNaOH = 0,05 mol
Đặt nAl = x và nAl2O3 = y (mol)
+) mhh X = 27x + 102y = 1,83 (1)
+) Hỗn hợp X tác dụng với NaOH:
Al + NaOH + H2O → NaAlO2 + 1,5 H2
x → x → 1,5x
Al2O3 + 2NaOH → 2NaAlO2 + H2O
y → 2y
→ nNaOH = x + 2y = 0,05 (2)
Giải hệ (1) (2) được x = 0,03 và y = 0,01
⟹ VH2 = 22,4.1,5x = 1,008 lít
Dạng 3: Bài tập về phản ứng nhiệt nhôm
* Một số ví dụ cụ thể:
Ví dụ 1: Hỗn hợp X gồm Fe3O4 và Al có tỉ lệ mol tương ứng là 1 : 3 thực hiện phản ứng nhiệt nhôm X (không có không khí) đến khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm
Hướng dẫn giải chi tiết:
3Fe3O4 + 8Al 9Fe + 4Al2O3
Ban đầu: 1 3
Ta thấy: 1/3 < 3/8 nên Fe3O4 phản ứng hết, Al còn dư.
Vậy sau khi phản ứng xảy ra hoàn toàn thu được hỗn hợp gồm Fe, Al2O3 và Al dư.
Ví dụ 2: Khi cho 20,7 gam hỗn hợp X gồm Fe2O3, Cr2O3 và Al2O3 tác dụng với dung dịch NaOH đặc dư, sau phản ứng thu được chất rắn có khối lượng 8 gam. Để khử hoàn toàn 41,4 gam X bằng phản ứng nhiệt nhôm phải dùng 10,8 gam Al. Thành phần phần trăm theo khối lượng của Al2O3 trong hỗn hợp X là
Hướng dẫn giải chi tiết:
Cr2O3 và Al2O3 tan trong dung dịch NaOH đặc dư → chất rắn còn lại là Fe2O3 có khối lượng 8 gam
→ = 0,05 mol
Gọi nCr2O3 = 2x mol
Khử 41,4 gam X bằng phản ứng nhiệt nhôm (lượng các chất lấy gấp đôi ban đầu)
2Al + Cr2O3 Al2O3 + 2Cr
4x ← 2x
2Al + Fe2O3 Al2O3 + 2Fe
0,2 ← 0,1
→ nAl cần dùng = 4x + 0,2 = 0,4 → x = 0,05