Tailieumoi.vn giới thiệu Giải bài tập Hóa học 8 Bài 34: Bài luyện tập 6, chi tiết nhất giúp học sinh dễ dàng làm bài tập Bài luyện tập 6 lớp 8.
Phương trình phản ứng:
2H2 + O2 2H2O (1)
4H2 + Fe3O4 4H2O + 3Fe (2)
3H2 + Fe2O3 3H2O + 2Fe (3)
H2 + PbO H2O + Pb (4)
+ Phản ứng (1) là phản ứng hóa hợp vì từ hai chất ban đầu sinh ra duy nhất 1 chất mới.
+ Phản ứng (2), (3) và (4) là phản ứng thế vì nguyên tử H đã thế chỗ của kim loại trong hợp chất.
Cả 4 phản ứng đều là phản ứng oxi hóa – khử vì H2 chiếm oxi của chất khác
Dùng một que đóm đang cháy cho vào mỗi lọ:
- Lọ cho que đóm sáng bùng lên: lọ chứa oxi.
- Lọ không làm thay đổi ngọn lửa: lọ chứa không khí.
- Lọ làm que đóm cháy với ngọn lửa màu xanh mờ và có tiếng nổ lách tách nhẹ là lọ chứa hiđro
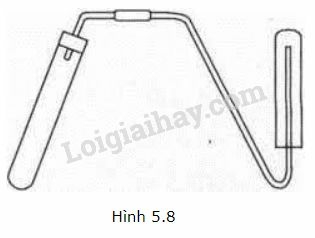
A. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí oxi.
B. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu không khí.
C. Có thể dùng các hóa chất và dụng cụ đã cho để điều chế và thu khí hiđro.
D. Có thể dùng để diều chế hiđro nhưng không thu được khí hiđro.
Lời giải:Ta thấy thí nghiệm thu khí bằng để ống nghiệm thẳng đứng và úp ống nghiệm xuống khí thu được phải nhẹ hơn không khí khí đó là khí hidro
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
- Cacbon đioxit + nước → Axit cacbonic (H2CO3)
- Lưu huỳnh đioxit +nước → Axit sunfurơ (H2SO3)
- Kẽm + axit clohiđric → Kẽm clorua + H2
- Điphotpho pentaoxit + nước → Axit photphoric (H3PO4)
- Chì (II) oxit + hiđro → Chì (Pb) + H2O
b. Mỗi phản ứng hóa học trên đây thuộc loại phản ứng nào? Vì sao?
Lời giải:a. Phương trình phản ứng.
CO2 + H2O → H2CO3 (1)
(kém bền)
SO2 + H2O → H2SO3 (2)
(kém bền)
Zn + 2HCl → ZnCl2 + H2 (3)
P2O5 + 3H2O → 2H3PO4 (4)
PbO + H2 → Pb + H2O (5)
b.+ Phản ứng (1), (2) và (4) là phản ứng hóa hợp vì từ 2 chất tạo ra 1 chất sản phẩm
+ Phản ứng (3) và (5) là phản ứng thế vì đơn chất phản ứng với hợp chất và thay chỗ cho một nguyên tử của hợp chất tạo thành sản phẩm.
+ Phản ứng (5) là phản ứng oxi hóa khử vì xảy ra cả sự khử và sự oxi hóa
b.Trong các phản ứng hóa học trên, chất nào là chất khử, chất nào là chất oxi hóa? Vì sao?
c. Nếu thu được 6,00 gam hỗn hợp hai kim loại, trong đó có 2,80 gam sắt thì thể tích (ở đktc) khí hiđro vừa đủ cần dùng để khử đồng (II) oxi và sắt (III) oxit là bao nhiêu?
Lời giải:a. PTHH:
(1)
(2)
b. Vì H2 là chất chiếm oxi của CuO và Fe2O3 nên H2 là chất khử
+ Vì CuO và Fe2O3 nhường oxi cho H2 nên CuO và Fe2O3 là chất oxi hóa
c. Ta có: mCu = 6 – 2,8 = 3,2 gam
Theo phương trình (1): lít
Lại có:
Theo phương trình (2):
a. Viết các phương trình phản ứng.
b. Cho cùng một khối lượng các kim loại trên tác dụng hết với axit dư thì kim loại nào cho nhiều khí hiđro nhất?
c. Nếu thu được cùng một thể tích khí hiđro thì khối lượng kim loại nào nhỏ nhất?
Lời giải:a. Phương trình phản ứng:
Zn + H2SO4 loãng → ZnSO4 + H2 ↑ (1)
2Al + 3H2SO4loãng → Al2(SO4)3 + 3H2 ↑ (2)
Fe + H2SO4 loãng → FeSO4 + H2 ↑ (3)
b. Giả sử khối lượng mỗi kim loại lấy phản ứng là a (gam)
Vậy số mol của Zn, Al và Fe lần lượt là:
Zn + H2SO4loãng → ZnSO4 + H2 ↑ (1)
(mol)
2Al + 3H2SO4loãng → Al2(SO4)3 + 3H2 ↑ (2)
Fe + H2SO4 loãng → FeSO4 + H2 ↑ (3)
(mol)
Ta thấy:
=> vậy cùng một lượng kim loại tác dụng với lượng axit dư thì kim loại nhôm sẽ cho nhiều khí hiđro hơn.
c. Giả sử cùng thu được thể tích khí H2 là 22,4 lít
Theo phương trình (1):
Theo phương trình (2):
Theo phương trình (3):
Vậy khối lượng kim loại nhỏ nhất là nhôm, tiếp theo là sắt và cuối cùng là kẽm.
1. Hiđro có nhiều ứng dụng, chủ yếu do tính chất rất nhẹ (nhẹ nhất trong các chất khí), tính khử và khi cháy tỏa nhiều nhiệt. Do hiđro là chất khí ít tan trong nước và nhẹ hơn không khí nên có thể thu hiđro vào bằng hai cách: đẩy không khí hoặc đẩy nước (miệng bình úp xuống dưới).
2. Có thể điều chế hiđro trong phòng thí nghiệm bằng dung dịch axit clohiđric HCl hoặc dung dịch axit sunfuric H2SO4 loãng tác dụng với kim loại như Zn, Al, Fe.
3. Khí hiđro có tính khử, ở nhiệt độ thích hợp hiđro không những hóa hợp với được các đơn chất oxi mà còn có thể hóa hợp với nguyên tố oxi trong một số oxit kim loại. Các phản ứng này đều tỏa nhiệt.
4. Phản ứng thế là phản ứng hóa học giữa đơn chất và hợp chất, trong đó nguyên tử của đơn chất thay thế nguyên tử của một nguyên tố trong hợp chất.
5. Sự khử là quá trình tách nguyên tử oxi khỏi hợp chất. Chất khử là chất chiếm oxi của chất khác.
6. Sự tác dụng của một chất với oxi là sự oxi hóa. Chất oxi hóa là đơn chất oxi hoặc chất nhường oxi cho chất khác.
7. Phản ứng oxi hóa – khử là phản ứng hóa học trong đó xảy ra đồng thời sự oxi hóa và sự khử.