Tailieumoi.vn xin giới thiệu đến các quý thầy cô Giáo án Hóa học 10 bài 30: Lưu huỳnh mới nhất theo mẫu Giáo án môn hóa học chuẩn của Bộ Giáo dục. Hi vọng tài liệu này sẽ giúp thầy/cô dễ dàng biên soạn chi tiết Giáo án môn Hóa học lớp10 . Chúng tôi rất mong sẽ được thầy/cô đón nhận và đóng góp những ý kiến quý báu của mình.
Mời các quý thầy cô cùng tham khảo và tải về chi tiết tài liệu dưới đây:
Biết được:
- Vị trí của lưu huỳnh trong bảng hệ thống tuần hoàn và cấu hình electron của nguyên tử.
- Hai dạng thù hình của lưu huỳnh.
- Tính chất hóa học cơ bản của lưu huỳnh là vừa có tính oxi hóa, vừa có tính khử.
- Trạng thái tự nhiên, ứng dụng và sản xuất lưu huỳnh.
Hiểu được:
- Vì sao lưu huỳnh vừa có tính oxi hóa, vừa có tính khử.
Vận dụng:
- Giải thích một số vấn đề mang tính thực tiễn đời sống và giải các bài tập liên quan.
- Dự đoán tính chất, kiểm tra, kết luận về tính chất của lưu huỳnh.
- Viết phương trình hóa học chứng minh tính chất hóa học của lưu huỳnh.
- Quan sát, mô tả hình ảnh.
- Giải các bài tập liên quan.
- Tính chất hóa học của lưu huỳnh.
- Giúp học sinh hiểu được tầm quan trọng của lưu huỳnh trong cuộc sống.
- Củng cố niềm tin vào khoa học thông qua việc học sinh làm thí nghiệm khám phá, tạo hứng thú cho học sinh, yêu thích môn hóa học hơn và khuyến khích sự tìm tòi, sáng tạo để chiếm lĩnh tri thức.
- Năng lực sử dụng ngôn ngữ hóa học.
- Năng lực quan sát.
- Năng lực tư duy hóa học.
- Năng lực tính toán hóa học.
- Dạy học khám phá.
- Sử dụng phương tiện trực quan (bài giảng powerpoint).
- Giáo viên:
+ Hình ảnh: bảng tuần hoàn; hai dạng thù hình của lưu huỳnh; trạng thái tự nhiên của lưu huỳnh.
+ Video: thí nghiệm H2 tác dụng S; S tác dụng O2
+ Phiếu học tập: bài tập trắc nghiệm củng cố.
+ Bài giảng powerpoint.
- Học sinh:
+ Ôn bài cũ “Oxi – Ozon”, chuẩn bị bài mới “Lưu huỳnh”.
Câu 1: Các con nhắc lại vị trí và cấu tạo của Oxi ( số hiệu nguyên tử, nhóm, chu kì) trong bảng tuần hoàn các nguyên tố hóa học.
Câu 2: Các con nhắc lại tính chất hóa học đặc trưng của oxi.
Ở tiết trước, chúng ta đã được học một nguyên tố của nhóm VIA là oxi. Hôm nay, chúng ta sẽ cùng nhau tìm hiểu một nguyên tố khác của nhóm này là lưu huỳnh để xem tính chất của lưu huỳnh có gì giống và khác so với oxi.
|
Hoạt động của GV |
Hoạt động của HS |
Nội dung ghi bảng |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Hoạt động 1: Vị trí, cấu hình electron nguyên tử (3 phút) - Trình chiếu BTH. Dựa vào BTH các nguyên tố hoá học, con hãy trả lời các thông tin sau : + Vị trí của lưu huỳnh: + Kí hiệu hóa học: + Nguyên tử khối: + Cấu hình electron: - GV lật mở đáp án, nhận xét và bổ sung (nếu thiếu).
|
+Vị trí: Ô thứ 16, chu kì 3, nhóm VIA +Kí hiệu hóa học: S +Nguyên tử khối: 32 +Cấu hình electron: 1s22s22p63s23p4 |
I. Vị trí, cấu hình electron nguyên tử +Vị trí: Ô thứ 16, chu kì 3, nhóm VIA +Kí hiệu hóa học: S +Nguyên tử khối: 32 +Cấu hình electron: 1s22s22p63s23p4
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
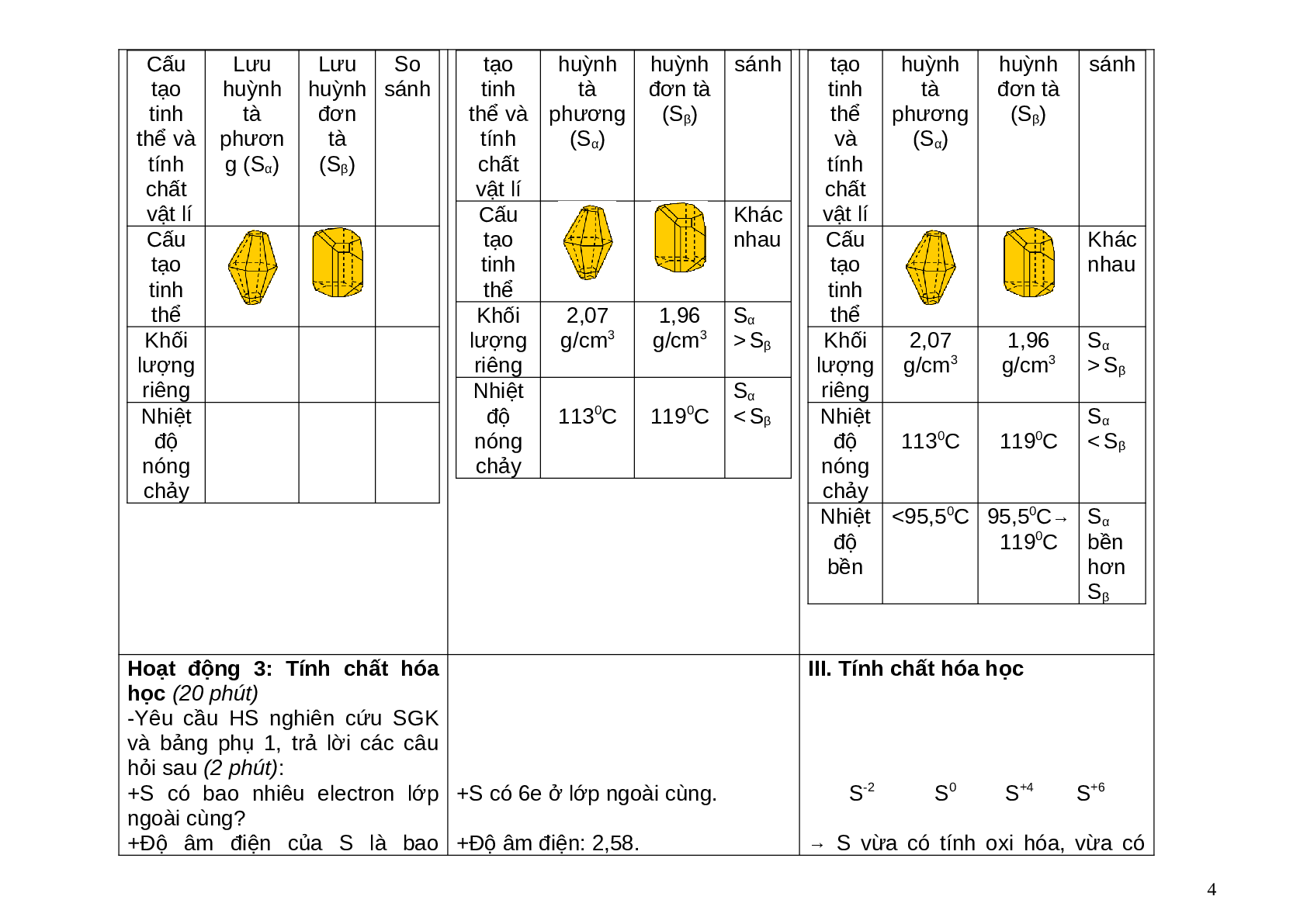
Hoạt động 2: Tính chất vật lí (3 phút) - Yêu cầu HS kết hợp nghiên cứu SGK và lên bảng trình bày và so sánh tính chất vật lí hai dạng thù hình của lưu huỳnh vào bảng phụ 2.
|
-Quan sát hình ảnh, nghiên cứu SGK để điền thông tin vào bảng phụ 2.
|
II. Tính chất vật lí
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Hoạt động 3: Tính chất hóa học (20 phút) -Yêu cầu HS nghiên cứu SGK và bảng phụ 1, trả lời các câu hỏi sau (2 phút): +S có bao nhiêu electron lớp ngoài cùng? +Độ âm điện của S là bao nhiêu? +Xác định số oxi hóa của S trong các chất sau: H2S, S, SO2, SO3. +Vậy S thể hiện tính chất gì?
1. Tính oxi hóa (13 phút) a, Tác dụng với kim loại (10 phút) - Cho các con xem video thí nghiệm giữa S và Fe. Sau đó yêu cầu HS trả lời các câu hỏi sau: • Nêu hiện tượng xảy ra. • Giải thích,viết phương trình hóa học. • Trong phản ứng này, S thể hiện tính chất gì?
b, Tác dụng với hiđro (3 phút) -Chiếu video thí nghiệm: H2 tác dụng S. Yêu cầu HS quan sát, mô tả cách tiến hành thí nghiệm, nêu hiện tượng, giải thích, gọi HS lên bảng viết phương trình hóa học.
-Kết luận tính oxi hóa của S.
2. Tính khử (5 phút) Lưu huỳnh tác dụng với phi kim:
-Các con theo dõi sgk và cho cô biết ở nhiệt độ thích hợp , lưu huỳnh tác dụng với 1 số phi kim nào? - Viết phương trình phản ứng?
KL: Số oxi hóa của S có thể giảm xuống -2 hoặc tăng lên +4,+6 nên khi tham gia phản ứng, tùy vào tác nhân mà S thể hiện tính khử hoặc tính oxi hóa. |
+S có 6e ở lớp ngoài cùng.
+Độ âm điện: 2,58. + S-2, S0, S+4, S+6
+S vừa có tính oxi hóa, vừa có tính khử.
-Ở điều kiện thích hợp lưu huỳnh tác dụng với một số phi kim mạnh hơn như: flo,oxi,clo…
|
III. Tính chất hóa học
S-2 S0 S+4 S+6
S vừa có tính oxi hóa, vừa có tính khử.
1. Tính oxi hóa a, Tác dụng với kim loại Fe + S → t0 FeS [K] [O] Sắt (II) sunfua
[K] [O] Thủy ngân (II) sunfua Chú ý: S tác dụng được với Hg ở nhiệt độ thường.
b Tác dụng với hiđro [K] [O] Hiđro sunfua
Kết luận: S0 + 2e S2- → S có tính oxi hóa.
Tính khử
[K] [O] Lưu huỳnh đioxit
[K] [O] Lưu huỳnh hexaflorua
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Hoạt động 4: Ứng dụng của lưu huỳnh (5 phút) - Các con kết hợp theo dõi SGK và những hiểu biết của bản thân hãy nêu một số ứng dụng của lưu huỳnh?
-Nhấn mạnh: S có nhiều ứng dụng quan trọng trong nhiều ngành công nghiệp. Tuy nhiên, việc lạm dụng S sẽ gây ra nhiều hậu quả khôn lường. |
- Lưu hóa cao su, tẩy trắng bột giấy, sản xuất diêm, dược phẩm, phẩm nhuộm, chất trừ sâu, chất diệt nấm...
|
IV. Ứng dụng của lưu huỳnh - Sản xuất H2SO4: S → SO2→ SO3→ H2SO4
- Lưu hóa cao su, tẩy trắng bột giấy, sản xuất diêm, dược phẩm, phẩm nhuộm, chất trừ sâu, chất diệt nấm...
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Hoạt động 5: Trạng thái tự nhiên và sản xuất lưu huỳnh (3 phút) -Chiếu hình ảnh trạng thái tự nhiên của lưu huỳnh. Yêu cầu HS nhận xét.
-Nhận xét và bổ sung (nếu thiếu). |
-Nhận xét: Trong tự nhiên, lưu huỳnh có nhiều ở dạng đơn chất, tạo thành những mỏ lớn trong vỏ Trái Đất.Ngoài ra còn tồn tại ở dạng hợp chất như các muối sunfat, muối sunfua,…
|
V. Trạng thái tự nhiên và sản xuất lưu huỳnh
-Trạng thái: +Có nhiều ở trạng thái đơn chất. +Ngoài ra, tồn tại trong hợp chất như: muối sunfat, muối sunfua,… |
- Phát phiếu học tập, chia lớp thành 4 nhóm, hoàn thành phiếu học tập.
|
Trường: …………………………………………………………… Lớp: ………………………… Tên thành viên:……………………………………………………………………………………………………………………
PHIẾU HỌC TẬPCâu 1: Dãy đơn chất nào sau đây vừa có tính khử, vừa có tính oxi hóa? A. Cl2, O3 , S. B. S, Cl2, Br2. C. Na, F2, S. D. Br2, O2, Ca.
Câu 2: Lưu huỳnh tác dụng với axit sunfuric đặc, nóng: S + 2H2SO4 3SO2 + 2H2O Trong phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị oxi hóa là: A. 1 : 2 B. 1 : 3 C. 3 : 1 D. 2 : 1
Câu 3: Đun nóng một hỗn hợp gồm có 0,81 g bột nhôm và 0,96 g bột lưu huỳnh trong ống nghiệm đậy kín không có không khí. Sau phản ứng, người ta thu được chất nào trong ống nghiệm và khối lượng là bao nhiêu? A. Al2S3: 1,5 (g). B. Al: 0,27 (g); Al2S3: 1,5 (g). C. Al: 0,54 (g); Al2S3: 1,5 (g). D. S: 0,32 (g).
|
Câu 1: B.
Câu 2: D.
Câu 3: B.
nZn = = 0,03 (mol); nS = = 0,03 (mol).
2Al + 3S Al2S3
Ban đầu: 0,03 0,03 (mol)
Phản ứng: 0,02 0,03 0,01 (mol)
Sau: 0,01 0 0,01 (mol)
Vậy sau phản ứng, trong ống nghiệm có:
Khối lượng của Al là: mAl = 0,01 27 = 0,27 (g).
Khối lượng của Al2S3 là: = 0,01 150 = 1,5 (g).
- Học bài cũ
- Chuẩn bị bài mới: đọc trước bài hợp chất của lưu huỳnh: Tính chất của oxi, lưu huỳnh.
VI. Đánh giá của GVHD
...............................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
GVHD SVTT
(ký tên) (ký tên)