Tailieumoi.vn xin giới thiệu Trắc nghiệm Hóa học lớp 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals sách Cánh diều. Bài viết gồm 20 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm Hóa học 10. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 12: Liên kết hydrogen và tương tác Van Der Waals. Mời các bạn đón xem:
Trắc nghiệm Hóa học 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Phần 1: Trắc nghiệm Liên kết hydrogen và tương tác Van Der Waals
Câu 1. Một loại liên kết rất yếu, hình thành bởi tương tác hút tĩnh điện giữa các cự trái dấu của phân tử là
A. tương tác van der waals
B. liên kết hydrogen
C. liên kết ion
D. liên kết cộng hóa trị
Đáp án: A
Giải thích: Tương tác van der waals là một loại liên kết rất yếu, hình thành bởi tương tác hút tĩnh điện giữa các cự trái dấu của phân tử.
Câu 2. Cho các phát biểu sau:
(1) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(2) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hóa trị.
(3) Tương tác van der waals yếu hơn liên kết hydrogen.
(4) Tương tác van der waals mạnh hơn liên kết hydrogen.
Những phát biểu đúng là
A. (1) và (3)
B. (1) và (4)
C. (2) và (3)
D. (2) và (4)
Đáp án: A
Giải thích:
Những phát biểu đúng là
(1) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(3) Tương tác van der waals yếu hơn liên kết hydrogen.
Câu 3. Liên kết hydrogen ảnh hưởng tới tính chất của nước như
A. đặc điểm tập hợp
B. nhiệt độ nóng chảy
C. nhiệt độ sôi
D. Cả A, B và C
Đáp án: D
Giải thích: Liên kết hydrogen ảnh hưởng tới tính chất của nước như: đặc điểm tập hợp, nhiệt độ nóng chảy và nhiệt độ sôi.
Câu 4. Nguyên nhân dẫn tới sự phân cực của các phân tử HCl, SO2, … là do
A. liên kết ion
B. liên kết cộng hóa trị không cực
C. liên kết cộng hóa trị có cực
D. liên kết hydrogen
Đáp án: C
Giải thích:
Nguyên nhân dẫn tới sự phân cực của các phân tử HCl, SO2, … là do liên kết cộng hóa trị có cực.
Câu 5. Phân tử nào dưới đây không có cực
A. HCl
B. CO2
C. H2O
D. NH3
Đáp án: B
Giải thích:
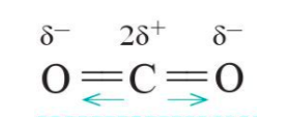
Liên kết C = O trong phân tử CO2 là liên kết có cực. Tuy nhiên phân tử CO2 có cấu tạo thẳng, hai liên kết C = O lại có cực ngược chiều nhau nên triệt tiêu lẫn nhau khi xét cho cả phân tử. Do đó phân tử CO2 không có cực.
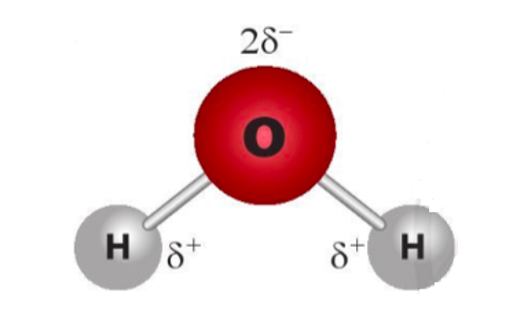
Câu 6. Cho sự phân bố điện tích trong phân tử H2O dưới đây. Liên kết giữa hai phân tử H2O có thể được hình thành qua cặp nguyên tử
A. O với O
B. O với H
C. H với H
D. Cả A, B và C.
Đáp án: B
Giải thích:
Liên kết giữa hai phân tử H2O có thể được hình thành qua nguyên tử H mang điện tích dương của phân tử H2O này với nguyên tử O mang điện tích âm của phân tử nước khác.
Vậy liên kết hình thành qua cặp nguyên tử O với H.
Câu 7. Loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng là
A. liên kết ion
B. liên kết cộng hóa trị có cực
C. liên kết cộng hóa trị không cực
D. liên kết hydrogen
Đáp án: D
Giải thích: Liên kết hydrogen là loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng.
Câu 8. Nguyên tử H trong phân tử H2O không tạo được liên kết hydrogen với
A. nguyên tử N trong phân tử NH3
B. nguyên tử F trong phân tử HF
C. nguyên tử O trong phân tử H2O
D. nguyên tử C trong phân tử CH4
Đáp án: D
Giải thích:
Công thức electron của các phân tử NH3; HCl; HF; CH4 lần lượt là:
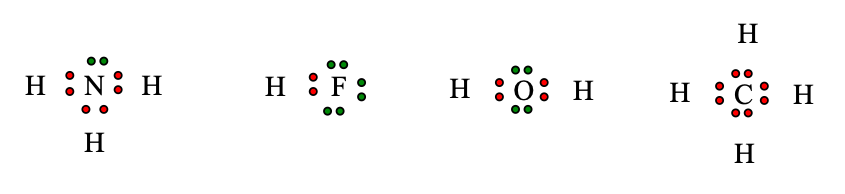
Nguyên tử C trong phân tử CH4 không còn cặp electron hóa trị riêng nên nguyên tử H trong phân tử H2O không tạo được liên kết hydrogen với nguyên tử C trong phân tử CH4.
Câu 9. Liên kết hydrogen xuất hiện giữa những phân tử cùng loại nào sau đây
A. CH4
B. NH3
C. H3C – O – CH3
D. PH3
Đáp án: B
Giải thích:
CH4: nguyên tử C không có cặp electron hóa trị riêng nên không xuất hiện liên kết hydrogen giữa các phân tử CH4.
NH3: nguyên tử N có cặp electron hóa trị riêng và nguyên tử H liên kết với nguyên tử N có độ âm điện lớn ⇒ xuất hiện liên kết hydrogen giữa các phân tử NH3
H3C – O – CH3, PH3: nguyên tử H không liên kết với nguyên tử có độ âm điện lớn nên không xuất hiện liên kết hydrogen giữa các phân tử.
Câu 10. Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là
A. N
B. O
C. F
D. Cả A, B và C
Đáp án: D
Giải thích: Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
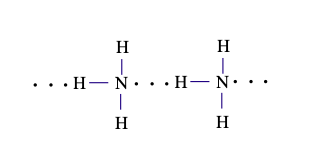
Câu 11. Liên kết được biểu diễn bằng các đường nét đứt được minh họa như hình dưới đây có vai trò quan trọng trong việc làm bền chuỗi xoắn đôi DNA. Đó là loại liên kết
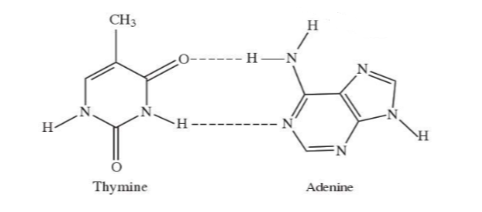
A. Liên kết ion
B. Liên kết cộng hóa trị có cực
C. Liên kết cộng hóa trị không cực
D. Liên kết hydrogen
Đáp án: D
Giải thích: Nguyên tử H liên kết với nguyên tử có độ âm điện lớn (N) của phân tử này liên kết với nguyên tử còn cặp electron hóa trị riêng của phân tử kia (N, O) thuộc loại liên kết hydrogen.
Câu 12. HF có nhiệt độ sôi cao hơn HBr là vì
A. Khối lượng phân tử của HF nhỏ hơn HBr
B. Năng lượng liên kết H – F lớn hơn H – Br
C. Giữa các phân tử HF có liên kết hydrogen còn HBr thì không
D. Cả A, B và C đều sai
Đáp án: C
Giải thích:
HF có nhiệt độ sôi cao hơn HBr là vì giữa các phân tử HF có liên kết hydrogen còn HBr thì không.
Để phá vỡ được liên kết hydrogen liên phân tử HF cần cung cấp năng lượng để phá vỡ liên kết và động năng để phân tử chuyển động nhiều hơn so với phân tử HBr. Do đó nhiệt độ sôi của HF cao hơn HBr.
Câu 13. Trong dung dịch NH3 (hỗn hợp NH3 và H2O) tồn tại số loại liên kết hydrogen là
A. 1
B. 2
C. 3
D. 4
Đáp án: D
Giải thích:
Liên kết hydrogen giữa nguyên tử H (liên kết với nguyên tử N có độ âm điện lớn) với nguyên tử N còn cặp electron hóa trị riêng.
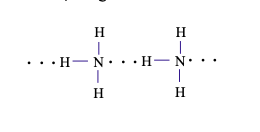
Liên kết hydrogen giữa nguyên tử H (liên kết với nguyên tử N có độ âm điện lớn) với nguyên tử O còn cặp electron hóa trị riêng.
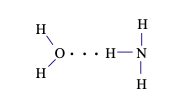
Liên kết hydrogen giữa nguyên tử H (liên kết với nguyên tử O có độ âm điện lớn) với nguyên tử O còn cặp electron hóa trị riêng.
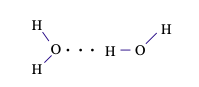
Liên kết hydrogen giữa nguyên tử H (liên kết với nguyên tử O có độ âm điện lớn) với nguyên tử N còn cặp electron hóa trị riêng.
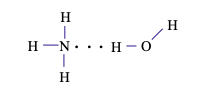
Câu 14. Giữa các phân tử C2H5OH
A. không tồn tại liên kết hydrogen
B. tồn tại liên kết hydrogen giữa nguyên tử H (liên kết với C) và nguyên tử O
C. tồn tại liên kết hydrogen giữa nguyên tử H (liên kết với O) và nguyên tử O
D. tồn tại liên kết hydrogen giữa nguyên tử H (liên kết với O) và nguyên tử C
Đáp án: C
Giải thích:
Giữa các phân tử C2H5OH tồn tại liên kết hydrogen giữa nguyên tử H (liên kết với O có độ âm điện lớn) và nguyên tử O còn cặp electron hóa trị riêng.
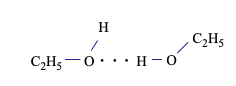
Câu 15. Bản chất hình thành liên kết hydrogen và tương tác van der waals đều do
A. sự góp chung electron
B. sự nhường – nhận electron
C. tương tác hút tĩnh điện
D. Cả A, B và C đều sai
Đáp án: C
Giải thích: Bản chất hình thành liên kết hydrogen và tương tác van der waals đều do tương tác hút tĩnh điện
Phần 2: Lý thuyết Liên kết hydrogen và tương tác Van Der Waals
I. Liên kết hydrogen
1. Khái niệm
- Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng.
- Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
- Liên kết hydrogen thường được kí hiệu là dấu ba chấm (...), rải đều từ nguyên tử H đến nguyên tử tạo liên kết hydrogen với nó.
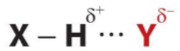
Trong đó, X, Y là các nguyên tử N, O, F
- Liên kết hydrogen có bản chất tĩnh điện. Tương tác hút tĩnh điện giữa và thể hiện bản chất của liên kết hydrogen.
Ví dụ 1: Liên kết hydrogen được tạo ra giữa hai phân tử nước được thể hiện qua hình 12.1.
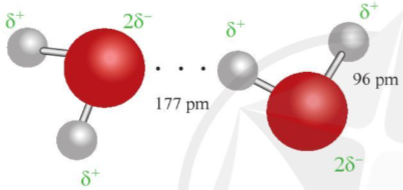
Hình 12.1. Liên kết hydrogen giữa hai phân tử nước
Ở khoảng cách 177 pm, lớn hơn độ dài liên kết cộng hóa trị O – H (96pm), đã xuất hiện liên kết hydrogen.
Lưu ý: Độ dài liên kết là khoảng cách giữa hai hạt nhân của hai nguyên tử tham gia liên kết.
2. Ảnh hưởng của liên kết hydrogen tới tính chất vật lí của nước
a) Đặc điểm tập hợp
- Nhờ liên kết hydrogen, các phân tử nước có thể tập hợp với nhau, ngay cả ở thể hơi, thành một cụm phân tử tương đối bền vứng. Kích thước các cụm phân tử này thay đổi tùy theo điều kiện nhiệt độ, áp suất.
® Đây là nguyên nhân dẫn tới các tính chất vật lí khác biệt của nước so với những chất lỏng khác. Do đặc điểm tập hợp đặc biệt này, khi làm lạnh, nước có thể hình thành bông tuyết với nhiều hình dạng khác nhau.
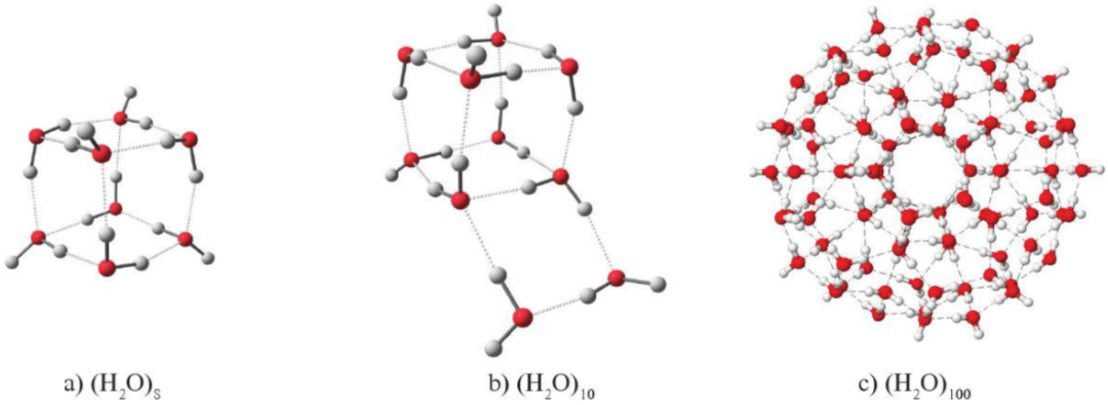
Hình 12.2. Một số cụm phân tử nước
b) Nhiệt độ nóng chảy và nhiệt độ sôi
- Tại áp suất 1atm, nước có nhiệt độ nóng chảy và nhiệt độ sôi tương ứng là 0oC và 100oC, cao hơn so với nhiều chất có khối lượng phân tử lớn hơn của nước. Tính chất này là do các phân tử nước liên kết khá chặt chẽ với nhau bởi các liên kết hydrogen.
Bảng 12.1. Nhiệt độ nóng chảy và nhiệt độ sôi của một số chất tại áp suất 1 atm
|
Chất |
Khối lượng phân tử (amu) |
Nhiệt độ nóng chảy (oC) |
Nhiệt độ sôi (oC) |
|
H2O |
18 |
0 |
100 |
|
H2S |
34 |
-82,3 |
-60,3 |
|
CO2 |
44 |
-57,0 |
-78,0 |
Chú ý: Để một chất có thể nóng chảy hoặc sôi, cần phải cung cấp năng lượng để phá vỡ các liên kết giữa các phân tử và cung cấp động năng để các phân tử chuyển động. Nhiệt độ nóng chảy và nhiệt độ sôi của chất phụ thuộc vào hai yếu tố:
(1) Khối lượng phân tử: Khối lượng phân tử càng lớn thì càng cần nhiều động năng để chuyển động nên nhiệt độ nóng chảy, nhiệt độ sôi càng cao.
(2) Liên kết giữa các phân tử: Số lượng liên kết giữa các phân tử càng nhiều, lực liên kết càng mạnh thì càng cần nhiều năng lượng để phá vỡ liên kết giữa chúng. Khi đó, nhiệt độ nóng chảy, nhiệt độ sôi của chất đó càng cao.
II. Tương tác van der Waals
Giữa các phân tử thậm chí không có liên kết hydrogen thì vẫn có tương tác với nhau, mặc dù yếu hơn. Đó là tương tác van der Waals.
1. Khái niệm
- Tương tác van der Waals là một loại liên kết yếu, hình thành do tương tác hút tĩnh điện giữa các cực trái dấu của phân tử.
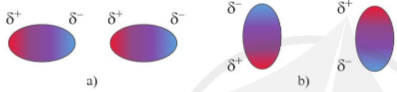
Hình 12.3. Các khả năng tương tác hút tĩnh điện giữa các cực trái dấu của hai phân tử
- Liên kết cộng hóa trị có cực là nguyên nhân dẫn tới sự phân cực ở các phân tử HCl, SO2, ...
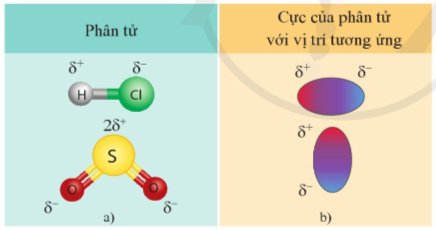
Hình 12.4. Một số phân tử có cực (a) và biểu diễn các cực của phân tử (b)
- Mặc dù có lực liên kết rất yếu, nhưng tương tác van der Waals lại có nhiều ảnh hưởng đến thực tiễn. Ví dụ: sự bám hút của các hạt bụi lên bề mặt nhẵn, sự hấp phụ các phân tử chất màu và chất độc hại trong nước bởi than hoạt tính, ...
Lưu ý: Phân tử CO2 không có cực, mặc dù liên kết C=O trong phân tử là liên kết có cực. Lí do bởi phân tử này có dạng thẳng, hai liên kết C=O lại có cực ngược chiều nhau nên triệt tiêu lẫn nhau khi xét cho cả phân tử
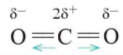
2. Ảnh hưởng của tương tác van der Waals tới tính chất vật lí của các chất
- Tương tự như liên kết hydrogen, tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất, nhưng ở mức độ ảnh hưởng yếu hơn so với liên kết hydrogen.
Xem thêm các bài trắc nghiệm Hóa học 10 Cánh diều hay, chi tiết khác:
Trắc nghiệm Hóa 10 Bài 11: Liên kết cộng hóa trị
Trắc nghiệm Hóa 10 Bài 12: Liên kết hydrogen và tương tác van der waals
Trắc nghiệm Hóa 10 Bài 13: Phản ứng oxi hóa – khử
Trắc nghiệm Hóa 10 Bài 14: Phản ứng hóa học và enthalpy
Trắc nghiệm Hóa 10 Bài 15: Ý nghĩa và cách tính biến thiên enthalpy phản ứng hóa học