Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Đề cương ôn tập học kì 1 môn Hoá Học lớp 11, tài liệu bao gồm 5 trang, giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi môn Hoá Học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
ĐỀ CƯƠNG ÔN TẬP HÓA HỌC 11 HỌC KỲ I
PHẦN THỨ NHẤT: LÝ THUYẾT
CĐ.SỰ ĐIỆN LI
1. SỰ ĐIỆN LI
- Sự điện li , chất điện li, những chất nào là chất điện li,
- Chất điện li mạnh là gì bao gồm những chất nào?cách viết phương trình điện li, tính mol và nồng độ các ion
- Chất điện li yếu: là gì ? bao gồm những chất nào ? cách viết phương trình điện li của chất điện li yếu.
2. AXIT - BAZƠ - MUỐI
- Các khái niệm axit,bazow, theo quan điểm của areniut, axit một nấc,nhiều nấc,bazow một nâc,nhiều nấc.
- Các khái niệm hidroxit lưỡng tính và nhớ được những hidroxit lưỡng tính hay gặp. Muối , phân biệt và lấy ví dụ muối axit và muối trung hòa.
3. Sự điện li của nước,p H, chất chỉ thị axit, bazo.
- Nước là chất điện li như thế nào khác? Biểu thức tích số ion của nước,ý nghĩa tích số só ion của nước
- p H , biểu thức tính p H, đánh giá môi trường dựa vào p H.
- chất chỉ thị axit, bazo là gì? Có những chất nào hay dùng,màu của chúng biến đổi như thế nao dựa vào giá trị p H.
- Các giá trị [H+] và pH đặc trưng cho các môi trường
4. Phản ứng trao đổi ion trong dung dịch các chất điện li
- Điều kiện xãy ra phản ứng trao đổi ion trong dung dịch các chất điện li, bản chất của phản ứng trao đổi ion trong dung dịch các chất điện li.
- Phương trình ion thu gọn, cách chuyển từ phương trinh phân tử sang ion thu gọn
- Phản ứng thủy phân của muối
- Phản ứng trao đổi ion trong dung dịch các chất điện li là phản ứng giữa các ion.
CĐ. NITO-PHOTPHO
1. NITƠ
- Vị trí - cấu hình electron nguyên tử,công thức phân tử,công thức cấu tạp phân tử nito.
- Tính chất vật lí,tính chất hóa học của nôt, viết các phương trinh phản ứng minh họa( dựa vào cấu tạo phân tử và số oxi hóa, độ âm điện để tư duy về tính chất hóa học )
- Điều chế nito trong phòng thí nghiệm, trong công nghiệp, trạng thái tự nhiên, ứng dụng.
2. AMONIAC - MUỐI AMONI
Amoniac
- Cấu tạo phân tử - Tính chất vật lý cần nhớ tính chất đặc trưng là khí mùi khai, nhẹ hơn không khí và tan rất nhiều trong nước, nhớ hình vẽ thí nghiệ về tính tan)
b. Tính chất hóa học
* Tính bazơ yếu
- Tác dụng với nước
![]()
Trong dung dịch amoniac là bazơ yếu. Có thể làm quỳ tím hóa xanh. Dùng để nhận biết NH3.
- Tác dụng với dung dịch muối, chú ý trong các phương trình phản ứng với dung dịch muối có mặt nước.
- Tác dụng với axit không cần nước.
* Tính khử, vì số oxi hóa của nito là thấp nhất.
Đồng thời NH3 kết hợp ngay với HCl tạo thành khói trắng.
c. Điều chế
* Trong phòng thí nghiệm * Trong công nghiệp
Muối amoni
a. Định nghĩa - Tính chất vật lý b. Tính chất hóa học
* Tác dụng với dung dịch kiềm. Phản ứng này để nhận biết ion amoni và điều chế amoniac
* Phản ứng nhiệt phân, các gốc axit có tính oxi hóa thì phản ứng xảy ra là phản ứng oxi hóa khử , gốc axit không có tính oxi hóa thì phản ứng tạo NH3.
3. AXIT NITRIC
. Cấu tạo phân tử - Tính chất vật lý
a. Cấu tạo phân tử- Trong hợp chất HNO3, nguyên tố nitơ có số oxi hoá cao nhất là +5.
b. Tính chất vật lý
. Tính chất hóa học
a. Tính axit - Axit nitric là một axit mạnh. Có đầy đủ tính chất của một axit.
b. Tính oxi hoá. Axit nitric là một trong những axit có tính oxi hoá mạnh..
. Điều chế
a. Trong phòng thí nghiệm , nhớ hình vẽ thí nghiệm. b. Trong công nghiệp . Quá trình sản xuất gồm ba giai đoạn :
4.. MUỐI NITRAT
- Muối nitrat là muối của axit nitric. Thí dụ, natri nitrat (NaNO3), đồng (II) nitrat (Cu(NO3)2),...
. Tính chất vật lí. . Tính chất hoá học, chú ý phản ứng nhiệt phân theo 3 loại muối. . Nhận biết ion nitrat
5.. PHOTPHO
Vị trí - Cấu hình electron nguyên tử. Tính chất vật lý, các dạng thù hình của photpho
Tính chất hóa học. của photpho và viết các phương trình phản ứng minh họa.
Trạng thái tự nhiên, điều chế.
6. AXIT PHOTPHORIC - MUỐI PHOTPHAT
. Axit photphoric
a. Tính chất hóa học
- Là một axit ba nấc, có độ mạnh trung bình. Có đầy đủ tính chất hóa học của một axit.
- Khi tác dụng với dung dịch kiềm, tùy theo lượng chất mà tạo ra các muối khác nhau.
b. Điều chế
* Trong phòng thí nghiệm * Trong công nghiệp
. Muối photphat
a. Định nghĩa
b. Nhận biết ion photphat
7. PHÂN BÓN HÓA HỌC
Cần nhớ các loại phân bón cơ bản cung cấp nguyên tố gì cho cây trồng, dạng nào, vai trò? Cách đánh giá độ dinh dưỡng, các loại phân bón cụ thể( thành phần chính, cách điều chế, tính chất
- Phân đạm cung cấp nitơ hóa hợp cho cây dưới dạng ion nitrat ![]() và ion amoni
và ion amoni ![]()
CĐ. CACBON-SILIC
1. CACBON
Vị trí - Cấu hình electron nguyên tử. Tính chất vật lý ( các loại thù hình cơ bản )
Tính chất hóa học
2. CACBON MONOXIT
Tính chất vật lí, Tính chất hóa học chú ý tính khử ( phản ứng với các oxit kim loại)
Điều chế
3. CACBON ĐIOXIT
Tính chất .Tính chất vật lý.Tính chất hóa học
Điều chế
4. AXIT CACBONIC - MUỐI CACBONAT
Axit cacbonic
. Muối cacbonat
- Tác dụng với dd axit - Tác dụng với dd kiềm - Phản ứng nhiệt phân
5. SILIC
. Tính chất vật lý - Silic có hai dạng thù hình: silic tinh thể và silic vô định hình.
. Tính chất hóa học .Tính khử. Tính oxi hóa
Điều chế
6. HỢP CHẤT CỦA SILIC
. Silic đioxit . Axit silixic Muối silicat
Dạng 1: Xác định chất điện li mạnh, yếu, không điện li; viết phương trình điện li.
Dạng 2: Tính nồng độ của các ion trong dung dịch chất điện li.
Dạng 3: Tính nồng độ H+, OH-, pH của dung dịch.
Dạng 4: Viết phương trình phản ứng trao đổi , viết phương trình ion thu gọn
Dạng 5: Tính toán dựa vào phương trình ion thu gọn
Dạng 6: Tính toán dựa vào định luật bảo toàn điện tích.
Dạng 1: Hoàn thành chuỗi viết pt pứ
Dạng 2: Nhận biết
Dạng 3. Bài tập tổng hợp NH3
Dạng 4: Bài tập muối amoni tác dụng với dung dịch kiềm.
Dạng 5: Bài tập tính oxi hóa mạnh của HNO3 ( dùng bảo toàn e và bảo toàn nguyên tố ).
Dạng 6: Nhiệt phân muối nitrat- hiệu suất phản ứng( dùng phương pháp tăng giảm khối lượng )
Dạng 1: Thực hiện chuỗi phản ứng.
Dạng 2: Nhận biết.
Dạng 3: Bài tập về muối cacbonat.
Dạng 4: Bài tập về tính khử của CO; C.
Dạng 5: Bài tập về phản ứng của CO2 với dung dịch kiềm.
Có 2 kiểu bài cơ bản
Kiểu 1: Xác định được tỉ lệ giữa kiềm và CO2, xác định muối tạo ra.
Kiểu 2: Bài toán ngược. Bài toán có đồ thị
BÀI TẬP
Bài 1:
a) Fe2(SO4)3 + NaOH b) NH4Cl + AgNO3 c) NaF + HCl
d) MgCl2 + KNO3 e) FeS(r) + HCl g) HClO + KOH
h) Na2CO3 + Ca(NO3)2 i) FeSO4 + NaOH loãng k) NaHCO3 + NaOH
l) NaHCO3 + HCl m) Pb(NO3)2 r + HNO3 n) Pb(NO3)2 r + NaOH
Bài 2: Cho 40 ml dd HCl 0,75 M vào 160 ml dd chứa đồng thời Ba(OH)2 0,08 M và KOH 0,04M. Xác định pH của dd thu được
Bài 3: Cho 220ml dung dịch HCl có pH = 5 tác dụng với 180ml dung dịch NaOH có pH = 9 thì thu được dung dịch A. Tình pH của dung dịch A?
Bài 4:. Cho dung dịch X gồm HNO3 và HCl có pH = 1. Trộn V (ml) dung dịch Ba(OH)2 0,025 M với 100ml dung dịch X thu được dung dịch Y có pH = 2. Xác định giá trị của V?
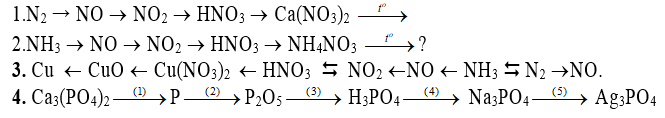
Bài 5:. Bằng phương pháp hóa học, hãy phân biệt các dung dịch sau: NH3, (NH4)2SO4, NH4Cl, Na2SO4. Viết các phương trình hóa học.
Bài 6:. Chỉ dùng một chất khác để nhận biết từng dung dịch sau: NH4NO3, NaHCO3, (NH4)2SO4, FeCl2, FeCl3. Viết phương trình các phản ứng xảy ra.
Bài 7. Có 6 bình mất nhãn, mỗi bình chứa một trong các dung dịch sau: natri sunfat, axit sunfuric, axit clohiđric, natri clorua, bari nitrat, bari hiđroxit. Chỉ dùng thêm một hoá chất làm thuốc thử hãy nhận biết các chất trên.
Bài 8:. Khi cho 2,95 gam hỗn hợp Cu và Al tác dụng với dung dịch HNO3 đặc dư, đun nóng sinh ra 4,48 lít khí duy nhất
NO2 (đktc). Xác định % khối lượng mỗi kim loại trong hỗn hợp.
Bài 9:. Hòa tan 24,8g hỗn hợp Fe và Cu trong dung dịch HNO3 dư thu được 6,72 lít NO (đktc). Khối lượng của muối tạo thành là bao nhiêu gam?
Bài 10:. Chia hỗn hợp gồm Cu và Al làm 2 phần bằng nhau:
Lần 1: Cho tác dụng hết với dung dịch HCl thu 6,72 lít khí (đkc).
Lần 2: Cho tác dụng hết với dung dịch HNO3 đặc nguội thu được 8,96 lít khí NO2 (đkc).
a) Viết các phương trình phản ứng xảy ra?
b) Tính % khối lượng mỗi kim loại có trong hỗn hợp?
Bài 11:. Hoà tan hoàn toàn 17,28 gam Mg vào dung dịch HNO3 0,1M thu được dung dịch A và 1,344 lít hỗn hợp khí X gồm N2 và N2O (ở 00C, 2 atm). Thêm một lượng dư KOH vào dung dịch A, đun nóng thì có một khí thoát ra. Khí này tác dụng vừa đủ với 200 ml dung dịch H2SO4 0,1 M. Tính thể tích mỗi khí trong hỗn hợp X?
Bài 12:. Hoà tan hoàn toàn 12,8g Cu trong dung dịch HNO3 thấy thoát ra V lít hỗn hợp khí A gồm NO, NO2 ở đktc. Biết tỉ khối của A đối với H2 là 19. Tính V?
Bài 13:. Nung 15,04 gam muối Cu(NO3)2 sau cùng thấy còn lại 8,56 gam chất rắn.
a, Tính % khối lượng Cu(NO3)2 bị phân huỷ.
b, Xác định thành phần chất rắn còn lại sau phản ứng.
Bài 14:. Một hỗn hợp gồm 8 mol N2 và 14 mol H2 được nạp vào 1 bình kín có dung tích 4 lít và giữ ở nhiệt độ không đổi. Khi phản ứng đạt trạng thái cân bằng thì áp suất bằng 10/11 áp suất ban đầu. Xác định hiệu suất phản ứng?
Bài 15:. Sục 6,72 lít khí CO2 (đktc) vào 200 ml dung dịch Ca(OH)2 1M. Tính khối lượng kết tủa thu được?
Bài 16.. Cho từ từ 150 ml HCl 1M vào 500 ml dung dịch A gồm Na2CO3 và NaHCO3 thì thu được 1,008 lít khí (đktc) và dung dịch B. Cho dung dịch B tác dụng với dung dịch Ba(OH)2 dư thì thu được 29,55 gam kết tủa. Xác định nồng độ mol của Na2CO3 và NaHCO3 trong dung dịch A ?
Bài 17:. Cho khí CO dư qua ống đựng a gam hỗn hợp gồm CuO, Fe3O4, FeO, nung nóng. Khí thoát ra được cho vào nước vôi trong dư thấy có 30g kết tủa trắng. Sau phản ứng, chất rắn trong ống sứ có khối lượng 202g. Xac dinh a?
Bài 18:. Cho luồng khí CO dư đi qua ống sứ đựng 16 gam Fe2O3 nung nóng. Sau một thời gian thu được hỗn hợp X gồm 4 chất rắn. Cho X tác dụng với H2SO4 đặc nóng, dư thu được dung dịch Y. Xác định khối lượng muối khan trong dung dịch Y?
Bài 19:. Cho 12g hỗn hợp MgO, CuO, Fe2O3 tác dụng với HCl 2M vừa đủ cần 225ml. Nếu lấy cùng hỗn hợp này cho tác dụng với CO dư thì được 10g chất rắn. Xác định thành phần % khối lựơng mỗi chất trong hỗn hợp đầu?
Bài 20:. Cho 4,48 lít CO (ở đktc) từ từ đi qua sống sứ nung nóng đựng 8 gam một oxit sắt đến khi phản ứng xảy ra hoàn toàn. Khí thu được sau phản ứng có tỉ khối so với hiđro bằng 20. Xác định công thức của oxit sắt và phần trăm thể tích của khí CO2 trong hỗn hợp khí?




