Thêm nước vào 10 mL dung dịch HCl 1,0 mol/L để được 1 000 mL dung dịch A. Dung dịch mới thu được có pH thay đổi như thế nào so với dung dịch ban đầu?
A. pH giảm đi 2 đơn vị.
B. pH giảm đi 0,5 đơn vị.
C. pH tăng gấp đôi.
D. pH tăng 2 đơn vị.
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: D
Pha loãng dung dịch 100 lần thì nồng độ giảm 100 lần => pH tăng 2 đơn vị.
Lý thuyết pH của dung dịch. Chuẩn độ acid – base
I. pH của dung dịch, chất chỉ thị
1. pH của dung dịch
|
pH = -lg[H+] hoặc [H+] = 10-pH
|
với [H+] là nồng độ mol của ion H+.
- Môi trường acid có pH < 7.
- Môi trường base có pH > 7.
- Môi trường trung tính có pH = 7.
2. Ý nghĩa của pH trong thực tiễn
- pH có ý nghĩa trong tự nhiên, trong sản xuất và trong cơ thể sống xảy ra trong dung dịch nước với sự có mặt của các acid – base.
3. Xác định pH bằng chất chỉ thị
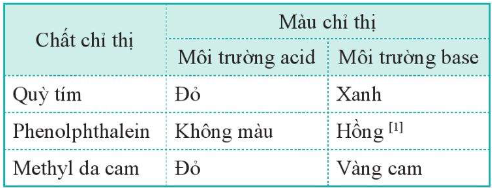
II. Chuẩn độ dung dịch acid và base
Nguyên tắc: Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ.
Sơ đồ tư duy pH của dung dịch. Chuẩn độ acid – base
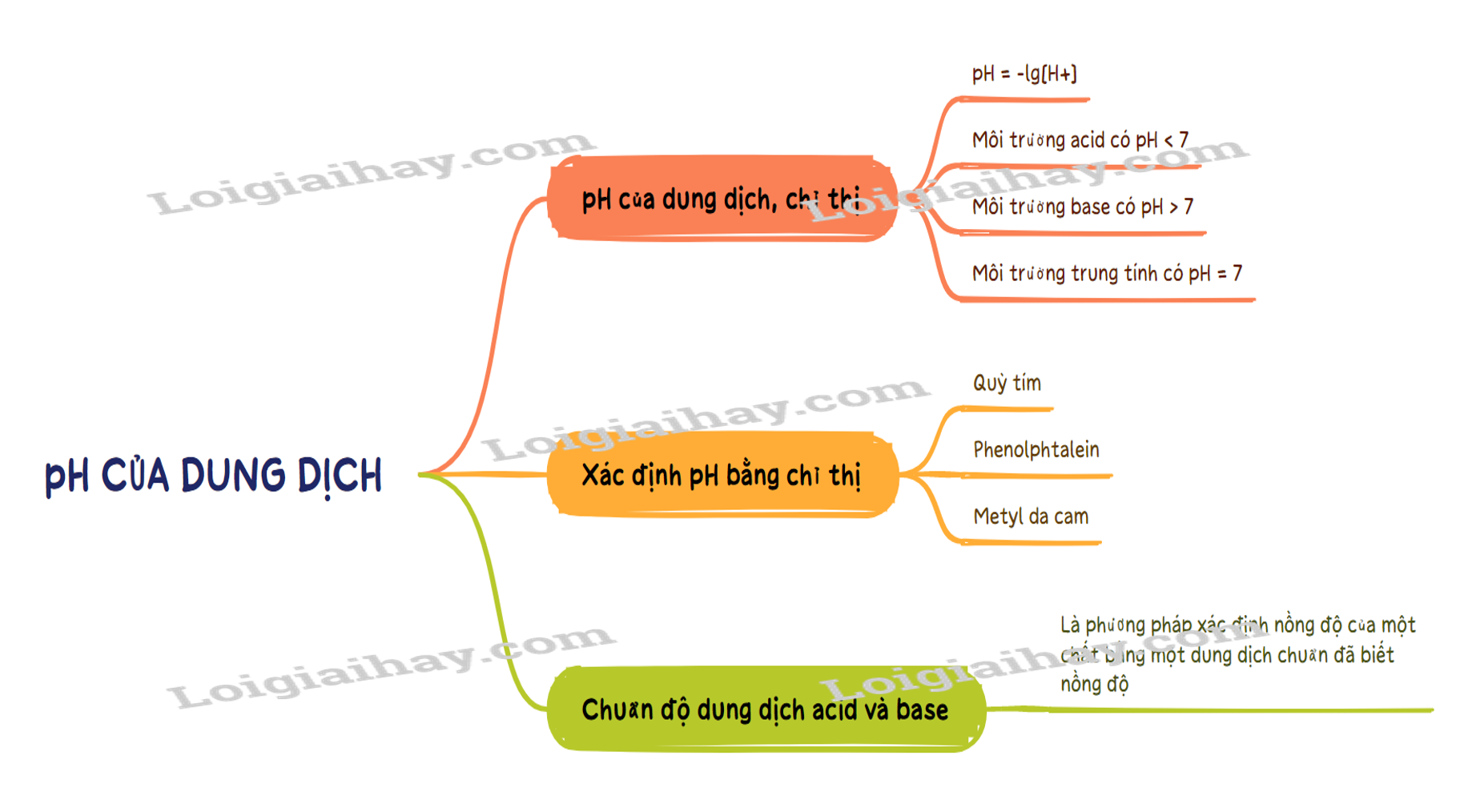
Xem thêm một số kiến thức liên quan:
15 câu Trắc nghiệm pH của dung dịch. Chuẩn độ acid – base (Cánh diều) có đáp án – Hóa học lớp 11
Lý thuyết pH của dung dịch. Chuẩn độ acid – base (Cánh diều) hay, chi tiết | Hóa học 11
Cho cân bằng hoá học sau:
CO(g) + H2O(g) ⇌ CO2(g) + H2(g)
Ở 700oC, hằng số cân bằng KC = 8,3. Cho 1 mol khí CO và 1 mol hơi nước vào bình kín, dung tích 10 lít và giữ ở 700oC. Tính nồng độ các chất ở trạng thái cân bằng.
Viết biểu thức hằng số cân bằng KC cho các phản ứng sau:
a) 2SO2(g) + O2(g) ⇌ 2SO3 (g)
b) 2C(s) + O2(g) ⇌ 2CO(g)
c) AgCl(s) ⇌ Ag+(aq) + Cl-(aq)
Xét phản ứng xảy ra trong lò luyện gang:
Fe2O3 (s) + 3CO(g) ⇌ 2Fe(s) + 3CO2(g) ∆rHo < 0
Nêu các yếu tố (nồng độ, nhiệt độ, áp suất) cần tác động vào cân bằng trên để cân bằng chuyển dịch về bên phải (làm tăng hiệu suất của phản ứng).
Cho cân bằng hoá học sau:
H2(g) + I2(g) ⇌ 2HI(g) = -9,6 kJ
Nhận xét nào sau đây không đúng?