Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 12 Bài 9: Amin chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Amin lớp 12
Bài giảng Hóa học 12 Bài 9: Amin
Bài 1 trang 44 SGK Hóa Học 11: Có 3 hóa chất sau đây: Etylamin, phenylamin và amoniac. Thứ tự tăng dần lực bazơ được xếp theo dãy
A. amoniac < etylamin < phenylamin.
B. etylamin < amoniac < phenylamin.
C. phenylamin < amoniac < etylamin.
D. phenylamin < etylamin < amoniac.
Lời giải:
Đáp án C. phenylamin < amoniac < etylamin.
Cần nhớ: Gốc đẩy electron làm tăng tính bazơ, gốc hút electron làm giảm tính bazơ. Càng nhiều gốc đẩy e thì tính bazơ càng mạnh và ngược lại càng nhiều gốc hút e thì tính bazơ càng yếu.
Do đó ta có thứ tự tính bazơ tăng dần như sau:
amin bậc III hút e < amin bậc II hút e < amin bậc I hút e < ![]() < amin bậc I đẩy e < amin bậc II đẩy e < amin bậc III đẩy e
< amin bậc I đẩy e < amin bậc II đẩy e < amin bậc III đẩy e
Nhóm đẩy: Những gốc ankyl (gốc hyđrocacbon no): ![]() , iso propyl …
, iso propyl …
Các nhóm còn chứa cặp e chưa liên kết: -OH (còn 2 cặp), ![]() (còn 1 cặp)….
(còn 1 cặp)….
Nhóm hút: tất cả các nhóm có chứa liên kết π, vì liên kết π hút e rất mạnh.
Những gốc hydrocacbon không no: ![]() …
…
Những nhóm khác chứa nối đôi như: -COOH (cacboxyl), -CHO (andehyt), -CO- (cacbonyl), - (nitro), ….
Các nguyên tố có độ âm điện mạnh: -Cl, -Br, -F (halogen)…
Bài 2 trang 44 SGK Hóa Học 11: Có thể nhận biết lọ đựng dung dịch CH3NH2 bằng cách nào trong các cách sau ?
A. Nhận biết bằng mùi;
B. Thêm vài giọt dung dịch H2SO4;
C. Thêm vài giọt dung dịch Na2CO3;
D. Đưa đũa thủy tinh đã nhúng vào dung dịch HCl đậm đặc lên phía trên miệng lọ đựng dung dịch CH3NH2 đặc.
Lời giải:
Đáp án D.
Khi cho ![]() tác dụng với dung dịch HCl đặc ta thấy xung quanh xuất hiện khói trắng. Dựa vào đó nhận biết được
tác dụng với dung dịch HCl đặc ta thấy xung quanh xuất hiện khói trắng. Dựa vào đó nhận biết được ![]() .
.
PTHH: ![]()
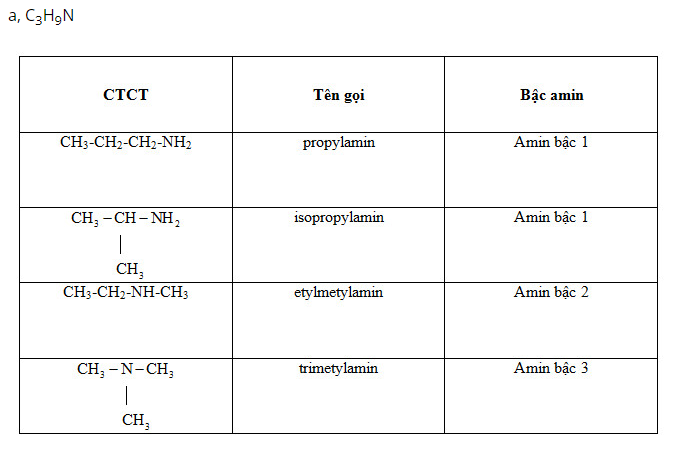
Bài 3 trang 44 SGK Hóa Học 11: Viết công thức cấu tạo, gọi tên và chỉ rõ bậc của từng amin đồng phân có công thức phân tử sau:
a) C3H9N;
b) C7H9N (chứa vòng benzen).
Lời giải:

Bài 4 trang 44 SGK Hóa Học 11: Trình bày phương pháp hóa học để tách riêng từng chất trong mỗi hỗn hợp sau đây:
a) Hỗn hợp khí: CH4 và CH3NH2;
b) Hỗn hợp lỏng: C6H6, C6H5OH và C6H5NH2.
Lời giải:
a. Tách hỗn hợp khí và
Cho hỗn hợp đi qua dung dịch HCl ta được phản ứng với HCl bị giữ lại trong dung dịch, khí thoát ra ngoài là tinh khiết.
PTHH:
Cho NaOH vào thu lại được
b. Tách hỗn hợp lỏng: và
Cho dung dịch NaOH vào hỗn hợp lỏng trên thu được dung dịch gồm hai phần: phần 1 tan là tạo thành và phần 2 hỗn hợp còn lại là và .
PTHH:
- Sục khí vào phần dung dịch tan ta thu lại được kết tủa .
- Với hỗn hợp và : cho tác dụng dung dịch HCl, thu được dung dịch gồm hai phần: phần tan là , phần không tan là . Lọc phần không tan ⇒ tách được .
PTHH:
Cho dung dịch NaOH vào phần dung dịch, ta thu lại được kết tủa.
PTHH:
Bài 5 trang 44 SGK Hóa Học 11: Hãy tìm phương pháp hóa học để giải quyết hai vấn đề sau:
a) Rửa lọ đã đựng anilin.
b) Khử mùi tanh của cá sau khi mổ để nấu. Biết rằng mùi tanh của cá (đặc biệt là cá mè) là do hỗn hợp một số amin (nhiều nhất là trimetylamin) và một số chất khác gây nên.
Lời giải:
a. Rửa lọ đã đựng anilin.
Cho vào lọ đựng anilin dung dịch HCl sau tráng bằng nước cất.
b. Khử mùi tanh của cá, ta cho vào một ít dấm các amin sẽ tạo muối với nên không còn tanh nữa.
Bài 6 trang 44 SGK Hóa Học 11: a) Tính thể tích nước brom 3% (D = 1,3 g/ml) cần dùng để điều chế 4,4 gam tribromanilin.
b) Tính khối lượng anilin có trong dung dịch A. Biết khi cho A tác dụng với nước brom thì thu được 6,6 gam kết tủa trắng.
Giả thiết rằng hiệu suất phản ứng của cả hai trường hợp trên là 100%
Lời giải:
a) C6H5NH2 + 3 Br2 → C6H2Br3NH2↓ + 3 HBr (1)
480 330 gam
x 4,4 gam
=> x= 4,4.480/330 = 6,4 gam
=>mddBr2 3%= 6,4.100/3=213,33 gam
VddBr2 3%= mddBr2 3%/D = 213,33/1,3 = 164,1 (ml).
b) C6H5NH2 + 3 Br2 → C6H2Br3NH2↓ + 3 HBr (2)
93 330 gam
y 6,6 gam
=> y = 6,6.93/330 = 1,86 gam
Lý thuyết Bài 9: Amin
I. KHÁI NIỆM, PHÂN LOẠI
1. Khái niệm
- Khi thay thế một hay nhiều nguyên tử hiđro trong phân tử NH3 bằng một hay nhiều gốc hiđrocacbon ta được amin.
VD: CH3–NH2 ; CH3–NH–CH3 ; CH2=CH–CH2NH2 ; C6H5NH2
2. Phân loại
- Amin được phân loại theo đặc điểm cấu tạo của gốc hiđrocacbon (amin thơm, amin béo, amin dị vòng) và theo bậc của amin (amin bậc một, bậc hai, bậc ba)
Lưu ý: Bậc của amin được tính bằng số gốc hidrocacbon liên kết trực tiếp với nguyên tử N
VD: CH3CH2CH2NH2 amin bậc 1
CH3CH2NHCH3 amin bậc 2
(CH3)3N amin bậc 3
II. ĐỒNG PHÂN, DANH PHÁP
1. Đồng phân
– Đồng phân về mạch cacbon.
– Đồng phân vị trí nhóm chức.
– Đồng phân về bậc của amin.
Ví dụ: Các đồng phân của C4H11N.
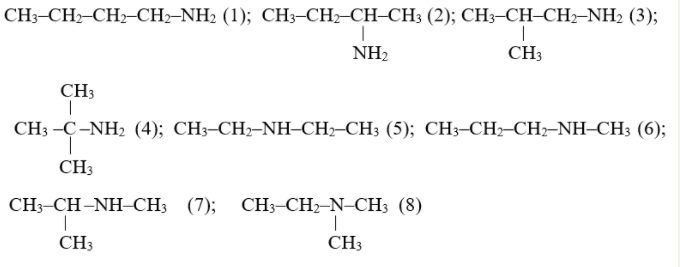
Cách 1: Tên gốc hiđrocacbon + amin
Cách 2: Tên hiđrocacbon + số chỉ vị trí nhóm NH2 + amin
Ví dụ: Tên gọi của một số amin
|
Hợp chất |
Tên gốc - chức |
Tên thay thế |
Tên thường |
|
CH3NH2 |
Metylamin |
Metanamin |
|
|
C2H5NH2 |
Etylamin |
Etanamin |
|
|
CH3CH2CH2NH2 |
Propylamin |
Propan - 1 – amin |
|
|
CH3CH(NH2)CH3 |
Isopropylamin |
Propan - 2 – amin |
|
|
H2N(CH2)6NH2 |
Hexametylenđiamin |
Hexan - 1,6 – điamin |
|
|
C6H5NH2 |
Phenylamin |
Benzenamin |
Anilin |
|
CH2=CH–CH2NH2 |
Anlylamin |
Prop-2-en-1-amin |
|
Tên gốc hiđrocacbon + amin
CH3–NH–C2H5 : Etylmetylamin
(CH3)3 –N : Trimetylamin
III. TÍNH CHẤT VẬT LÍ
- -Metyl-; -đimetyl-; trimetyl- và etylamin là những chất khí mùi khai khó chịu, độc, dễ tan trong nước.
- Các chất đồng đẳng cao hơn là những chất lỏng hoặc rắn, độ tan trong nước giảm dần theo chiều tăng của phân tử khối.
- Anilin là chất lỏng, không màu, rất độc, ít tan trong nước, tan trong etanol, benzen.
IV. TÍNH CHẤT HÓA HỌC
1. Tính bazo
Amin tan nhiều trong nước có khả năng làm xanh giấy quỳ hoặc làm hồng phenolphtalein, tính bazo mạnh hơn amoniac. Anilin có tính bazo nhưng không làm đổi màu quỳ tím cũng không làm hồng phenolphtalein do tính bazo của nó yếu hơn amoniac.
TQ: Amin thơm < amoniac < amin béo
a) Tác dụng với dung dịch axit tạo thành dung dịch muối:
RNH2 + HCl → RNH3Cl
b) Tác dụng với một số dung dịch muối có môi trường axit
3RNH2 + FeCl3 + 3H2O → Fe(OH)3 + 3RNH3Cl
2. Phản ứng với axit nitro
- Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ.
C2H5NH2 + HONO → C2H5OH + N2 + H2O
- Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 - 5oC) cho muối điazoni :
C6H5NH2 + HONO+HCl C6H5N2+Cl- + 2H2O
3. Phản ứng ankyl hóa
Ta có phương trình tổng quát:
RNH2 + R’I → RNHR’ + HI
4. Phản ứng thế brom vào nhân thơm của anilin

Sản phẩm tạo ra kết tủa trắng nên đây là phản ứng đặc trưng dùng để nhận biết anilin với các amin khác
V. ỨNG DỤNG
Các ankylamin được dùng trong tổng hợp hữu cơ, đặc biệt là các điamin được dùng để tổng hợp polime.
Anilin là nguyên liệu quan trọng trong công nghiệp phẩm nhuộm (phẩm azo, đen anilin,…), polime (nhựa anilin - fomanđehit,…), dược phẩm (streptoxit, suafaguaniđin,…)
VI. ĐIỀU CHẾ
- Thay thế nguyên tử H của phân tử amoniac
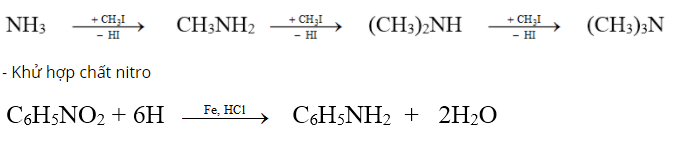
Dạng 1: Lý thuyết về amin
* Một số ví dụ điển hình
Ví dụ 1: Phát biểu nào sau đây không đúng ?
A. Amin được cấu thành bằng cách thay thế H của NH3 bằng một hay nhiều gốc hiđrocacbon.
B. Bậc của amin là bậc của nguyên tử cacbon liên kết với nhóm amin.
C. Tùy thuộc cấu trúc của gốc hidrocacbon, có thể phân biệt thành amin no, chưa no và thơm.
D. Amin có từ 2 nguyên tử cacbon trong phân tử, bắt đầu xuất hiện hiện tượng đồng phân.
Hướng dẫn giải chi tiết:
Bậc của amin là số nguyên tử H trong phân tử NH3 bị thế bởi nhóm hidro cacbon
=> B sai
Đáp án B
Ví dụ 2: Số đồng phân amin bậc một ứng với công thức phân tử C4H11N là :
A. 2.
B. 5.
C. 3.
D. 4.
Hướng dẫn giải chi tiết:
Đối với amin, có 2 loại đồng phân là đồng phân mạch C và đồng phân vị trí nhóm chức.
Các đồng phân amin bậc 1 ứng với công thức phân tử C4H11N là:
CH3-CH2-CH2-CH2-NH2 (1)
CH3-CH2-CH(NH2)-CH3 (2)
CH3-CH(CH3)-CH2-NH2 (3)
CH3-C(CH3)(NH2)-CH3 (4)
Đáp án D.
Ví dụ 3: Nguyên nhân amin có tính bazơ là :
A. Có khả năng nhường proton.
B. Trên N còn một đôi electron tự do có khả năng nhận H+.
C. Xuất phát từ amoniac.
D. Phản ứng được với dung dịch axit.
Hướng dẫn giải chi tiết:
Nguyên nhân amin có tính axit là do trên N còn 1 đôi electron tự do có khả năng nhận H+
Đáp án B
Ví dụ 4: Hãy sắp xếp các chất sau đây theo trật tự tăng dần tính bazơ : (1) amoniac ; (2) anilin ;
(3) etylamin ; (4) đietylamin ; (5) kalihiđroxit.
A. (2) < (1) < (3) < (4) < (5).
B. (1) < (5) < (2) < (3) < (4).
C. (1) < (2) < (4) < (3) < (5).
D. (2) < (5) < (4) < (3) < (1).
Hướng dẫn giải chi tiết:
Để xét tính bazo của aminno axit, phụ thuộc vào gốc hidrocacbon liên kết với nhóm amino.
Gốc hidro cacbon đẩy e => Làm tăng tính bazo của amin hơn so với NH3
Gốc hidrocacbon hút e => Làm giảm tính bazo của amin hơn so với NH3
Anilin có chứa nhóm hút e
=> Tính bazo của anilin nhỏ hơn so với NH3 (I)
(4) có nhiều gốc đẩy e hơn so với (3)
=> dietyl amin > etylamin > amoniac (II)
=> Ta có được thứ tự là: (2) < (1) < (3) < (4) < (5)
Đáp án A
Dạng 2: Amin tác dụng với dung dịch axit, muối
* Một số lưu ý cần nhớ:
- Bản chất của phản ứng của amin tác dụng với dung dịch axit là:
-NH2 + H+ → -NH3+
(Phản ứng xảy ra tương tự với amin bậc 2, bậc 3)
- Các amin no có khả năng phản ứng được với dung dịch muối của một số kim loại tạo hidroxit kết tủa
VD: -NH2 + Fe3+ + H2O → -NH3+ + Fe(OH)3
* Lưu ý: NH3 không có khả năng hòa tan được Al(OH)3 (Khác với dung dịch kiềm)
- NH3 không tạo kết tủa với muối của dung dịch đồng, bạc, …
* Một số ví dụ điển hình:
Ví dụ 1: Cho 10 gam amin đơn chức X phản ứng hoàn toàn với HCl (dư), thu được 15 gam muối. Số đồng phân cấu tạo của X là :
A. 5.
B. 8.
C. 7.
D. 4.
Hướng dẫn giải chi tiết
Áp dụng định luật bảo toàn khối lượng ta có:
m HCl phản ứng = m muối – m X
=> m HCl = 15 – 10 = 5 gam
=> n HCl = 5/36,5 (mol)
Ta có : n X = n HCl = 5/36,5 (X là amin đơn chức nên sẽ phản ứng với HCl theo tỉ lệ 1:1)
=> M X = 10 : 5 /36,5 = 73 (gam/mol)
=> X là : C4H11N
Các đồng phân của X là:
* Amin bậc 1:
CH3-CH2-CH2-CH2-NH2 (1)
CH3-CH2-CH(NH2)-CH3 (2)
CH3-CH(CH3)-CH2-NH2 (3)
(CH3)2-C(NH2)-CH3 (4)
* Amin bậc 2:
CH3-NH-CH2-CH2-CH3 (5)
CH3-NH-CH(CH3)-CH3 (6)
CH3-CH2-NH-CH2-CH3 (7)
* Amin bậc 3:
(CH3)2N-CH2-CH3 (8)
Đáp án B.
Ví dụ 2: Hỗn hợp X gồm metylamin, etylamin và propylamin có tổng khối lượng 21,6 gam là và tỉ lệ về số mol là 1 : 2 : 1. Cho hỗn hợp X trên tác dụng hết với dung dịch HCl thu được dung dịch chứa bao nhiêu gam muối ?
A. 36,2 gam.
B. 39,12 gam.
C. 43,5 gam.
D. 40,58 gam.
Hướng dẫn giải chi tiết:
Gọi số mol của CH3NH2, C2H5NH2, C3H7NH2 lần lượt là x, 2x, x (mol)
Khối lượng của 3 amin là 21,6 gam
=> 31x + 45.2x + 59x = 21,6 => x = 0,12
Tổng số mol của 3 amin là : 0,12 + 0,12 .2 + 0,12 = 0,48 (mol)
=> n HCl = n Amin = 0,48 mol
Áp dụng định luật bảo toàn khối lượng ta có:
m Amin + m HCl = m Muối
=> m Muối = 21,6 + 0,48 . 36,5 = 39,12 gam
Đáp án B
Ví dụ 3: Cho 21,9 gam amin đơn chức X phản ứng hoàn toàn với dung dịch FeCl3 (dư), thu được 10,7 gam kết tủa. Số đồng phân cấu tạo bậc 1 của X là :
A. 5.
B. 8.
C. 7.
D. 4.
Hướng dẫn giải chi tiết
Ta có phương trình phản ứng:
3RNH2 + Fe3+ + H2O → 3[RNH3]+ + Fe(OH)3 (1)
n Fe(OH)3 = 10,7 : 107 = 0,1 (mol)
n Amin = 3 n Fe(OH)3 = 0,3 mol
=>Khối lượng mol của amin là: 21,9 : 0,3 = 73 gam/mol
=> X là : C4H9NH2
=> Số đồng phân cấu tạo bậc 1 của X là:
CH3-CH2-CH2-CH2-NH2 (1)
CH3-CH2-CH(NH2)-CH3 (2)
CH3-CH(CH3)-CH2-NH2 (3)
CH3-C(CH3)(NH2)-CH3 (4)
Đáp án D.
Dạng 3: Bài toán đốt cháy amin
* Một số lưu ý cần nhớ:
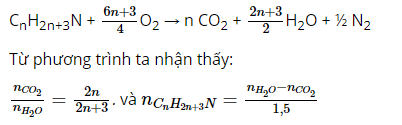
* Một số ví dụ điển hình:
Ví dụ 1: Đốt cháy hoàn toàn hỗn hợp hai amin no, đơn chức, là đồng đẳng liên tiếp, thu được 2,24 lít khí CO2 (đktc) và 3,6 gam H2O. Công thức phân tử của2 amin là :
A. CH5N và C2H7N.
B. C2H7N và C3H9N.
C. C3H9N và C4H11N.
D. kết quả khác.
Hướng dẫn giải chi tiết:
n H2O = 3,6 : 18 = 0,2 (mol)
n CO2 = 2,24 : 22,4 = 0,1 (mol)
=> Số mol của hỗn hợp amin là : (0,2 – 0,1) : 1,5 = 0,2/3 (mol)
Số nguyên tử C trung bình có trong hỗn hợp amin là:
n CO2 : n Amin = 0,1 : 0,2/3 = 1,5
2 amin thuộc dãy đồng đẳng liên tiếp
=> Công thức của 2 amin là CH5N và C2H7N
Đáp án A.
Ví dụ 2: : Khi đốt cháy hoàn toàn một amin đơn chức X, thu được 16,80 lít khí CO2 ; 2,80 lít N2 (các thể tích đo ở đktc) và 20,25 gam H2O. CTPT của X là :
A. C4H9N.
B. C3H7N.
C. C2H7N.
D. C3H9N
Hướng dẫn giải chi tiết:
n N2 = 2,8 : 22,4 = 0,125 (mol)
n Amin = n N (có trong amin) = 0,125 . 2 = 0,25 (mol)
n CO2 = 16, 8 : 22,4 = 0,75 (mol)
=> Số nguyên tử C có trong amin là: 0,75 : 0,25 = 3
n H2O = 20,25 : 18 = 1,125 (mol)
=> Số nguyên tử H có trong amin là: 1,125 . 2 : 0,25 = 9
=> CTPT của amin là: C3H9N
Đáp án D.
Dạng 4: Bài toán về phản ứng của amin với HNO2 và phản ứng thế ở vòng benzen
* Một số lưu ý cần nhớ:
Amin bậc một tác dụng với axit nitrơ ở nhiệt độ thường cho ancol hoặc phenol và giải phóng nitơ. Ví dụ :
C2H5NH2+HONO→ C2H5OH + N2 + H2O
Anilin và các amin thơm bậc một tác dụng với axit nitrơ ở nhiệt độ thấp (0 - 5oC) cho muối điazoni :
C6H5NH2+ HONO + HCl C6H5N2+Cl- + 2H2O
phenylđiazoni clorua
* Một số ví dụ điển hình:
Ví dụ 1: 0,1 mol etylamin tác dụng hết với dung dịch HNO2 dư thu được V lít khí N2. Giá trị của V là
Hướng dẫn giải chi tiết:
C2H5NH2 + HNO2 → C2H5OH + N2 + H2O
0,1 mol → 0,1 mol
=> V = 0,1.22,4 = 2,24 lít
Ví dụ 2: Hỗn hợp 1,07 gam hai amin đơn chức bậc nhất kế tiếp nhau trong dãy đồng đẳng phản ứng vừa hết với axit Nitrơ ở nhiệt độ thường tạo nên dung dịch X. Cho X phản ứng với Na dư thu được 0,03 mol H2. Công thức 2 amin là
Hướng dẫn giải chi tiết:
Đặt công thức trung bình của 2 amin là .
Sơ đồ phản ứng :
Theo sơ đồ ta thấy số mol 2 amin là 0,03 mol.
Vậy