Tailieumoi.vn xin giới thiệu phương trình C4H8 + 6O2 → 4CO2 + 4H2O gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình C4H8 + 6O2 → 4CO2 + 4H2O
1. Phản ứng hóa học:
C4H8 + 6O2 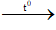
2. Điều kiện phản ứng
- Đốt cháy.
3. Cách thực hiện phản ứng
- Đốt cháy khí buten trong không khí, sau phản ứng thu được khí CO2 và hơi nước.
4. Hiện tượng nhận biết phản ứng
- Phản ứng trên gọi là phản ứng oxi hóa hoàn toàn.
- Khi đốt cháy anken, số mol H2O thu được sau phản ứng luôn bằng số mol CO2.
5. Tính chất hóa học
5.1. Tính chất hóc học của C4H8
a. Phản ứng cộng
- Hướng phản ứng cộng axit và nước vào anken.
+ Phản ứng cộng axit hoặc nước vào buten không đối xứng thường tạo ra hỗn hợp 2 đồng phân, trong đó 1 đồng phân là sản phẩm chính.
b. Phản ứng trùng hợp
- Buten trong điều kiện nhiệt độ, áp xuất, xúc tác thích hợp thì tham gia phản ứng cộng nhiều phân tử với nhau thành những phân tử mạch rất dài và có khối lượng phân tử rất lớn. Người ta gọi đó là phản ứng trùng hợp.
c. Phản ứng oxi hóa
- Buten cháy hoàn toàn tạo ra CO2, H2O và tỏa nhiều nhiệt:
C4H8 + 6O2 → 4CO2 + 4H2O
- Buten làm mất màu dung dịch KMnO4:
C4H8 + 4KMnO4 + 2H2O → 4KOH + 4MnO2 + 3C4H8(OH)2
- Phản ứng làm mất màu dung dịch thuốc tím kali pemanganat được dùng để nhận ra sự có mặt của liên kết đôi của anken.
5.2. Tính chất hóa học của O2
Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
a. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ au và Pt), cần có to tạo oxit:
b. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
c. Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
- Tác dụng với các chất hữu cơ:
6. Bạn có biết
- Phản ứng trên gọi là phản ứng oxi hóa hoàn toàn.
- Khi đốt cháy anken, số mol H2O thu được sau phản ứng luôn bằng số mol CO2.
7. Bài tập liên quan
Ví dụ 1: Hỗn hợp A gồm 1 ankan và 1 anken. Số nguyên tử H trong ankan bằng số nguyên tử C trong anken. Đốt cháy 3 g hỗn hợp A thu được 5,4g H2O. CTPT và % khối lượng các chất trong A là:
A. CH4: 46,67%; C4H8 : 53,33%
B. CH4: 53,33%; C4H8: 46,67%
C. C2H6: 33,33%; C6H12: 66,67%
D. C2H6: 66,67%; C6H12: 33,33%
Hướng dẫn:
nH2O = 0,3 với mA = 3 = 12. NCO2 + 2. NH2O ⇒ nCO2 = 0,2 mol
⇒ nAnkan = 0,3 – 0,2 = 0,1 với mAnkan < 3 ⇒ MAnkan < 30 chọn 16 là CH4 và Anken C4H8 ⇒ %CH4 = 0,1.16/3 = 0,533
Đáp án B.
Ví dụ 2: Đốt cháy hoàn toàn khí C4H8 , dẫn toàn bộ sản phẩm cháy dẫn qua bình 1 đựng H2SO4 đặc, bình 2 đựng nước vôi trong dư thấy khối lượng bình 1 tăng 9g, bình 2 tăng m gam. Giá trị của m là:
A. 22 g
B. 44
C. 66 g
D. 11 g
Hướng dẫn:
C4H8 + 6O2 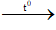
nH2O = nCO2 = 0,5 mol ⇒ mbình tăng 2 = mCO2 = 0,5.44 = 22 g
Đáp án A
Ví dụ 3: Chia hỗn hợp 3 anken: C2H4, C3H6, C4H8 thành 2 phần bằng nhau:
- Đốt cháy phần 1 sinh ra 5,4g H2O
- Phần 2 cho tác dụng với hiđro (có Ni xúc tác), đốt cháy sản phẩm sau phản ứng rồi dẫn sản phẩm cháy vào bình đựng nước vôi trong dư thì khối lượng kết tủa thu đựơc là:
A. 29g
B. 30g
C. 31g
D. 32g
Hướng dẫn
Với anken nH2O = nCO2 = 0,3 → Khi đốt thành phần CO2 không đổi → m↓ = 30g
Đáp án B.
8. Một số phương trình phản ứng hóa học khác của Anken và hợp chất
3C4H8 + 4H2O + 2KMnO4 → 3C4H8(OH)2 + 2MnO2 + 2KOH
CH2=CH–CH2– CH2–CH3 + HBr → CH3-CHBr–CH2–CH2–CH3
CH3- C(CH3)=CH–CH3 + HBr → CH3–C(CH3)Br–CH2 -CH3