Tailieumoi.vn giới thiệu Giải bài tập Hóa học lớp 12 Bài 36: Sơ lược về niken, kẽm, chì, thiếc chính xác, chi tiết nhất giúp học sinh dễ dàng làm bài tập Sơ lược về niken, kẽm, chì, thiếc lớp 12.
Bài giảng Hóa học 12 Bài 36: Sơ lược về niken, kẽm, chì, thiếc
Giải bài tập Hóa học 12 Bài 36: Sơ lược về niken, kẽm, chì, thiếc
Câu hỏi và bài tập (trang 163 SGK Hóa Học 12)
Bài 1 trang 163 SGK Hóa Học 12: Dãy nào sau đây sắp xếp các kim loại đúng theo thứ tự tính khử tăng dần?
A. Pb, Ni, Sn, Zn ; B. Pb, Sn, Ni, Zn ;
C. Ni, Sn, Zn, Pb ; D. Ni, Zn, Pb, Sn .
Lời giải:
Bài 2 trang 163 SGK Hóa Học 12: Sắt tây là sắt được phủ lên bề mặt bởi kim loại nào sau đây ?
A. Zn ; B. Ni ;
C. Sn ; D. Cr.
Lời giải:
Bài 3 trang 163 SGK Hóa Học 12: Cho 32 gam hỗn hợp gồm MgO, Fe2O3, CuO tác dụng vừa đủ với 300 ml dung dịch H2SO4 2M. Khối lượng muối thu được là :
A.60 gam. B. 80 gam.
C. 85 gam. D. 90 gam.
Phương pháp giải:
Gọi công thức chung của tất cả các oxit là M2Ox
M2Ox + xH2SO4 → M2(SO4)x + xH2O
nO (trong oxit) = nH2SO4 = ?
=> mKL = mhh – mO = ?
mmuối = mKL + mSO42-
Lời giải:
Cách 1:
Gọi công thức chung của tất cả các oxit là M2Ox
M2Ox + xH2SO4 → M2(SO4)x + xH2O
Từ PTHH =>nO (trong oxit) = nH2SO4 = 0,6 (mol)
=> mKL = mhh – mO = 32 - 0,6.16 = 22,4 (g)
mmuối = mKL + mSO42-
= 22,4 + 0,6.96
=80 (g)
Cách 2:
Các PTHH:
Nhận xét: 1 mol oxit phản ứng tạo thành 1 mol muối
khối lượng tăng = 96 – 16 = 80 gam
mmuối = 32 + 80.0,6 = 80 gam
Đáp án B.
Bài 4 trang 163 SGK Hóa Học 12: Hợp chất nào sau đây không có tính lưỡng tính ?
A. ZnO ; B. Zn(OH)2 ;
C. ZnSO4 ; D. Zn(HCO3)2.
Lời giải:
Bài 5 trang 163 SGK Hóa Học 12: Cho dung dịch NaOH vào dung dịch muối sunfat của một kim loại có hóa trị II thấy sinh ra kết tủa tan trong dung dịch NaOH dư. Muối sunfat đó là muối nào sau đây ?
A. MgSO4 B. CaSO4 ;
C. MnSO4 ; D. ZnSO4.
Lời giải:
Kết tủa tan được trong dung dịch NaOH dư thì chỉ có thể là muối của ZnSO4.
ZnSO4 + 2NaOH → Zn(OH)2↓ + Na2SO4
Zn(OH)2 + 2NaOH dư → Na2ZnO2 + 2H2O
Đáp án D
Lý thuyết Bài 36: Sơ lược về Niken, kẽm, chì, thiếcI. NIKEN
- Thuộc nhóm VIIIB, chu kì 4, số hiệu nguyên tử là 28.
- Cấu hình electron nguyên tử : [Ar]3d84s2.
- Thường có số oxi hóa +2 trong các hợp chất.
1. Tính chất của Niken
- Tính chất vật lý: là kim loại có màu trắng bạc, rất cứng, khối lượng riêng lớn, nóng chảy ở 1455 độ C
- Có tính khử yếu : tác dụng với phi kim ở nhiệt độ cao; tác dụng với dung dịch axit; tác dụng với dung dịch muối; bền với nước và không khí ở nhiệt độ thường.
Ni + 4HNO3 (đặc, nóng) → Ni(NO3)2 + 2NO2 + 2H2O
2. Ứng dụng của Niken
- Niken: hơn 80% lượng Ni sản xuất được dùng trong ngành luyện kim
- Ngoài ra Ni còn được dùng: mạ lên sắt để làm đẹp, chống gỉ và còn được dùng làm chất xúc tác.
II. KẼM
- Thuộc nhóm IIB, chu kì 4, số hiệu nguyên tử là 30.
- Cấu hình electron nguyên tử : [Ar]3d104s2.
- Thường có số oxi hóa +2 trong các hợp chất.
1. Tính chất của Zn
- Tính chất vật lý: là kim loại màu lam nhạt, trong không khí ẩm bị phủ một lớp oxit mỏng nên có màu xám nhạt; có khối lượng riêng lớn; khá giòn nên không kéo dài được, nhưng ở 100- 150oC lại dẻo và dai còn trên 200oC lại giòn và có thể tán thành bột.
Lưu ý: kẽm ở trạng thái rắn và hợp chất của kẽm không độc, riêng hơi ZnO thì rất độc
- Tính chất hóa học: Có tính khử mạnh hơn sắt
+ Tác dụng với phi kim ở nhiệt độ cao
+ Tác dụng với dung dịch muối và axit
+ Bền với nước và không khí ở nhiệt độ thường.
2. Ứng dụng của Zn
- Kẽm được mạ lên tôn để chống gỉ và còn được dùng làm pin khô
- Một số hợp chất của Zn dùng trong y học, chẳng hạn như ZnO dùng làm thuốc giảm đau dây thần kinh, chữa bệnh eczema, bệnh ngứa,...
III. CHÌ
- Thuộc nhóm IVA, chu kì 6, số hiệu nguyên tử là 82.
- Cấu hình electron nguyên tử : [Xe]4f145d106s26p2.
- Thường có số oxi hóa là +2, +4 nhưng số oxi hóa +2 phổ biến và bền hơn.
1. Tính chất của Pb
- Tính chất vật lý:
+ Là kim loại có màu trắng hơi xanh, khối lượng riêng lớn, mềm và dễ dát thành lá mỏng.
+ Chì và hợp chất của chì đều rất độc. Khi vào cơ thể có thể gây ra bệnh làm xám men răng và rối loạn thần kinh
- Có tính khử yếu :
+ Bị oxi hóa ở nhiệt độ cao.
+ Tác dụng chậm với dung dịch HCl và H2SO4 loãng tạo Sn (II) và khí H2.
+ Tan trong kiềm đặc: NaOH, KOH.
Ví dụ:
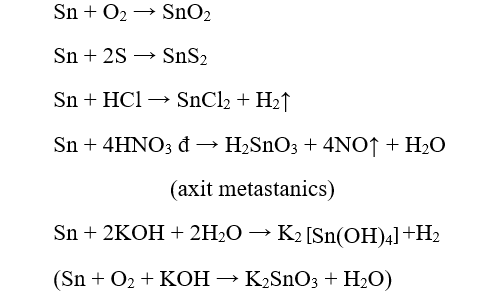
2. Ứng dụng của Pb
Được dùng để chế tạo bản cực acquy, vỏ dây cáp, đầu đạn và chế tạo thiết bị chống tia phóng xạ.
IV. THIẾC
- Thiếc thuộc nhóm IVA, chu kì 5, số hiệu nguyên tử là 50.
Cấu hình electron nguyên tử : [Kr]4d105s25p2.
- Có số oxi hóa +2 và +4 trong các hợp chất.
1. Tính chất của Sn
- Tính chất vật lý:
+ Màu trắng bạc, khối lượng riêng lớn, mềm dễ dát mỏng
+ Tồn tại ở hai dạng thù hình là thiếc trắng và thiếc xám, biến đổi lẫn nhau phụ thuộc vào nhiệt độ
- Có tính khử yếu hơn Ni :
+ Tác dụng với phi kim ở nhiệt độ cao
+ Tác dụng chậm với dung dịch axit (HNO3 loãng : Sn -> Sn2+ ; H2SO4, HNO3 đặc : Sn -> Sn4+ )
+ Tác dụng với dung dịch muối; bền với nước và không khí ở nhiệt độ thường
Pb + 2KOH → K2PbO2 + H2
+ Bị hòa tan trong dung dịch kiềm đặc.
2. Ứng dụng của Sn
- Sn được mạ lên sắt để chống gỉ ( sắt tây) dùng trong công nghiệp thực phẩm
- Lá thiếc mỏng dùng trong tụ điện; hợp kim thiếc chì dùng để hàn
- SnO2 được dùng làm men trong công nghiệp gốm sứ và làm thủy tinh mờ