Tailieumoi.vn xin giới thiệu bộ đề thi học kì 2 môn Hóa học lớp 10 sách Chân trời sáng tạo năm 2024 – 2025. Tài liệu gồm 4 đề thi có ma trận chuẩn bám sát chương trình học và đáp án chi tiết, được biên soạn bởi đội ngũ giáo viên THPT dày dặn kinh nghiệm sẽ giúp các em ôn tập kiến thức và rèn luyện kĩ năng nhằm đạt điểm cao trong bài thi học kì 2 Hóa học 10. Mời các bạn cùng đón xem:
Chỉ từ 60k mua trọn bộ Đề thi học kì 2 Hóa học 10 Chân trời sáng tạo bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
A. Ma trận đề thi Học kì 2 Hóa học lớp 10 (Chân trời sáng tạo)
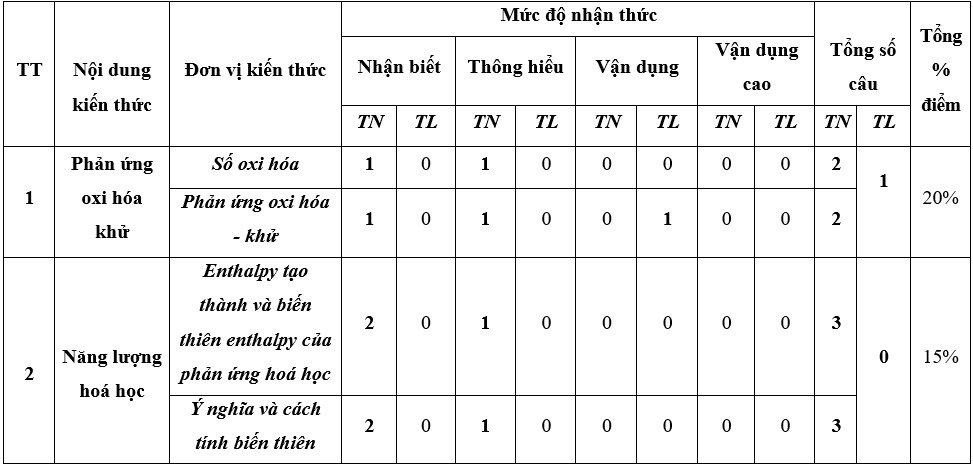
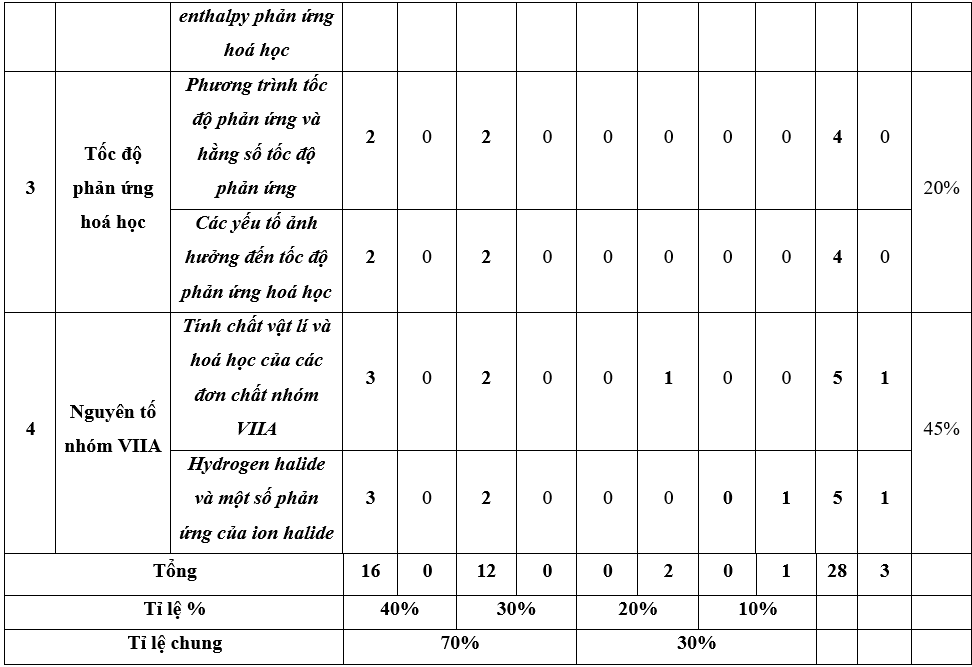
Đề thi học kì 2 Hóa học lớp 10 Chân trời sáng tạo có đáp án - Đề 1
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2 - Chân trời sáng tạo
Năm học .................
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của sulfur trong hợp chất H2SO3 là
A. +2. B. +4.
C. +6. D. +8.
Câu 2: Cho các hợp chất sau: N2, N2O, NH3, HNO3, (NH4)2CO3. Số trường hợp trong đó nitrogen có số oxi hoá -3 là
A. 4. B. 3.
C. 2. D. 1.
Câu 3: Cho các phản ứng hoá học sau:
(a) 2HCl + Fe → FeCl2 + H2.
(b) 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
(c) HCl + KOH → KCl + H2O.
(d) 2HCl + Na2CO3 → 2NaCl + CO2 + H2O.
Số phản ứng trong đó HCl thể hiện tính khử là
A. 1. B. 2.
C. 3. D. 4.
Câu 4: Nguyên tử nitrogen chỉ thể hiện tính oxi hoá (trong điều kiện phản ứng phù hợp) trong hợp chất nào sau đây?
A. N2. B. NH3.
C. NO. D. NaNO3.
Câu 5: Cho phương trình nhiệt hóa học của phản ứng:
C(s) + H2O(g) CO(g) + H2(g)
Phản ứng trên là phản ứng
A. thu nhiệt.
B. không có sự thay đổi năng lượng.
C. tỏa nhiệt.
D. có sự giải phóng nhiệt lượng ra môi trường.
Câu 6: Dựa vào phương trình nhiệt hóa học của phản ứng sau:
Giá trị của phản ứng 2CO(g) + O2(g) → 2CO2(g) là
A. – 283 kJ.
B. + 283 kJ.
C. + 566 kJ.
D. – 566 kJ.
Câu 7: Phản ứng nảo sau đây là phản ứng tỏa nhiệt?
A. Phản ứng nhiệt phân thuốc tím (KMnO4).
B. Phản ứng nhiệt phân Fe(OH)3.
C. Phản ứng đốt cháy cồn (ethanol).
D. Phản ứng nung NH4Cl(s) tạo ra NH3(g) và HCl(g).
Câu 8: Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
A. 2C(than chì) + O2(g) → 2CO(g).
B. C(than chì) + O(g) → CO(g).
C. C(than chì) + .
D. C(than chì) + CO2(g) → 2CO(g).
Câu 9: Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau:
2NO2(g) (đỏ nâu) → N2O4(g) (không màu)
Biết NO2 và N2O4 có tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
A. tỏa nhiệt, N2O4 bền vững hơn NO2.
B. thu nhiệt, N2O4 bền vững hơn NO2.
C. tỏa nhiệt, NO2 bền vững hơn N2O4.
D. thu nhiệt, NO2 bền vững hơn N2O4.
Câu 10: Cho phản ứng tổng hợp ammonia (NH3) như sau:
N2(g) + 3H2(g) → 2NH3(g)
Biết năng lượng liên kết (kJ/mol) của N≡N và H–H lần lượt là 946 và 436. Năng lượng liên kết của N–H trong ammonia là
A. 391 kJ/mol.
B. 361 kJ/mol.
C. 245 kJ/mol.
D. 490 kJ/mol.
Câu 11: Tốc độ phản ứng viết theo định luật tác dụng khối lượng là
A. tốc độ trung bình của phản ứng.
B. tốc độ tức thời của phản ứng.
C. tốc độ tính trung bình trong một khoảng thời gian phản ứng.
D. tốc độ tính theo chất sản phẩm phản ứng.
Câu 12: Đối với phản ứng: , phát biểu nào sau đây đúng?
A. Tốc độ tiêu hao chất B bằng 3/2 tốc độ tạo thành chất C.
B. Tốc độ tiêu hao chất B bằng 2/3 tốc độ tạo thành chất C.
C. Tốc độ tiêu hao chất B bằng 3 tốc độ tạo thành chất C.
D. Tốc độ tiêu hao chất B bằng 1/3 tốc độ tạo thành chất C.
Câu 13: Phản ứng của H2 và I2 là phản ứng đơn giản: H2(g) + I2(g) → 2HI(g). Theo định luật tác dụng khối lượng, tốc độ của phản ứng này được viết dưới dạng là
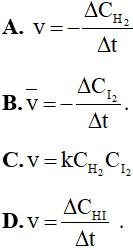
Câu 14: Tốc độ của một phản ứng hóa học lớn nhất khoảng thời điểm nào?
A. Bắt đầu phản ứng.
B. Khi phản ứng được một nửa lượng chất so với ban đầu.
C. Gần cuối phản ứng.
D. Không xác định được.
Câu 15: Yếu tố nào được sử dụng để tăng tốc độ phản ứng trong trường hợp sau: “Sự cháy diễn ra mạnh và nhanh hơn khi đưa lưu huỳnh (sulfur) đang cháy ngoài không khí vào lọ đựng khí oxygen”?
A. Nồng độ.
B. Áp suất.
C. Nhiệt độ.
D. A, B, C đều đúng.
Câu 16: Hệ số nhiệt độ Van’t Hoff được kí hiệu là
A. ∝. B. γ.
C. φ. D. θ.
Câu 17: Chất làm tăng tốc độ phản ứng mà sau phản ứng nó không bị thay đổi về lượng và chất được gọi là
A. chất ức chế.
B. chất xúc tác.
C. chất hoạt hóa.
D. chất điện li.
Câu 18: Cho ba mẫu đá vôi (không lẫn tạp chất) có cùng khối lượng: mẫu 1 dạng khối, mẫu 2 dạng viên nhỏ, mẫu 3 dạng bột mịn vào ba cốc đựng cùng thể tích dung dịch HCl (dư, cùng nồng độ, ở điều kiện thường). Thời gian để đá vôi tan hết trong ba cốc tương ứng là t1, t2, t3 giây. So sánh nào sau đây đúng?
A. t3 < t2 < t1.
B. t2 < t1 < t3.
C. t1 < t2 < t3.
D. t1 = t2 = t3.
Câu 19: Trong dãy các halogen, khi đi từ fluorine đến iodine thì
A. bán kính nguyên tử giảm dần.
B. độ âm điện giảm dần.
C. khả năng oxi hoá tăng dần.
D. năng lượng liên kết trong phân tử đơn chất tăng dần.
Câu 20: Trong các tính chất sau, những tính chất nào không phải là chung cho các đơn chất halogen?
A. Phân tử gồm 2 nguyên tử.
B. Có số oxi hoá -1 trong hợp chất với kim loại và hydrogen.
C. Có tính oxi hoá.
D. Tác dụng mạnh với nước.
Câu 21: Trong số các hydrohalic acid dưới đây, chất có tính khử mạnh nhất là
A. HF. B. HCl.
C. HBr. D. HI.
Câu 22: Dung dịch nào dưới đây không tác dụng với dung dịch AgNO3?
A. NaF. B. NaCl.
C. NaBr. D. Na2SO4.
Câu 23: Để chứng minh Cl2 vừa có tính khử vừa có tính oxi hóa, người ta cho Cl2 tác dụng với
A. dung dịch FeCl2.
B. dây sắt nóng đỏ.
C. dung dịch NaOH loãng.
D. dung dịch KI.
Câu 24: Cấu hình electron lớp ngoài cùng của các ion halide (X-) là
A. ns2np4.
B. ns2np5.
C. ns2np6.
D. (n – 1)d10ns2np5.
Câu 25: Phản ứng nào sau đây là sai?
A. 2F2 + 2H2O → 4HF + O2.
B. Cl2 + H2O ⇄ HCl + HClO.
C. Br2 + H2O ⇄ HBr + HBrO.
D. F2 + H2O ⇄ HF + HFO.
Câu 26: Hydrogen halide có nhiệt độ sôi cao nhất là
A. Hydrogen chloride.
B. Hydrogen fluoride.
C. Hydrogen bromide.
D. Hydrogen iodide.
Câu 27: Rót 3 mL dung dịch HCl 1 M vào 2 mL dung dịch NaOH 1 M, cho quỳ tím vào dung dịch sau phản ứng, mẩu quỳ tím sẽ:
A. hóa màu đỏ.
B. hóa màu xanh.
C. mất màu tím.
D. không đổi màu.
Câu 28: Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính khử.
(b) Hydrofluoric acid là acid yếu.
(c) Trong hợp chất, các halogen đều có số oxi hóa: -1, +1, +3, +5 và +7.
(d) Tính khử của các ion halogenua tăng dần theo thứ tự: F–, Cl–, Br–, I–.
Trong các phát biểu trên, số phát biểu sai là
A. 2. B. 4.
C. 3. D. 5.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Để điều chế khí chlorine (Cl2) trong phòng thí nghiệm, người ta thường cho potassium permanganate (KMnO4) tác dụng với hydrogen chloride (HCl):
a) Lập phương trình hóa học của phản ứng hóa học trên bằng phương pháp thăng bằng electron, chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử.
b) Giả sử lượng khí chlorine sinh ra phản ứng vừa đủ với dung dịch chứa 9,96 muối KX (X là một nguyên tố halogen) thu được 4,47 gam một muối duy nhất. Xác định công thức phân tử của muối KX.
Câu 2 (1 điểm): Hoàn thành các phương trình minh hoạ tính chất hoá học của các nguyên tố halogen:
a) Cl2 + Fe →
b) Cl2 + KOH
c) Br2 + KI →
d) I2 + Al
e) Ag + F2 →
Câu 3 (1 điểm): Cho 2,9825 gam hỗn hợp A gồm: NaX, NaY (X, Y là hai halogen liên tiếp, nguyên tử khối của X nhỏ hơn của Y) vào dung dịch AgNO3 dư. Kết thúc phản ứng thu được 0,7175 gam kết tủa. Xác định hai nguyên tố X, Y.
Hướng dẫn giải đề số 1
|
1 - B |
2 - C |
3 - A |
4 - D |
5 - A |
6 - D |
7 - C |
8 - C |
9 - A |
10 - A |
|
11 - B |
12 - A |
13 - C |
14 - D |
15 - A |
16 - B |
17 - B |
18 - C |
19 - B |
20 - D |
|
21 - D |
22 - A |
23 - C |
24 - C |
25 - D |
26 - B |
27 - A |
28 - A |
|
|
Câu 9:
= (N2O4) – 2. (NO2)
= 9,16 – 2.33,18 = -57,2 (kJ) < 0.
Phản ứng tỏa nhiệt, N2O4 bền hơn NO2.
Câu 10:
Ta có: = EN≡N + 3.EH–H – 6.EN–H
Þ
Phần II: Tự luận
Câu 1:
a)
Chất khử: HCl.
Chất oxi hoá: KMnO4.
Quá trình khử:
Quá trình oxi hoá:
Phương trình hoá học được cân bằng:
b)
Cl2 + 2KX → 2KCl + X2
Vậy MX = 166 – 39 =127 nên KX là KI.
Câu 2:
a) 3Cl2 + 2Fe → 2FeCl3.
b) 3Cl2 + 6KOH 5KCl + KClO3 + 3H2O.
c) Br2 + 2KI → 2KBr + I2.
d) 3I2 + 2Al 2AlI3.
e) 2Ag + F2 → 2AgF.
Câu 3:
Trường hợp 1: X là fluorine, Y là chlorine.
Phương trình hoá học:
NaCl + AgNO3 → NaNO3 + AgCl
Kết tủa là AgCl.
Þ nNaCl = n↓ = 0,005 mol Þ mNaCl = 0,005.58,5 = 0,2925 < mA.
Vậy trường hợp 1 thỏa mãn.
Trường hợp 2: Cả hai muối halogen đều tạo kết tủa
Đặt hai muối NaX và NaY tương ứng với 1 muối là (MNaX < < MNaY)
Phương trình hoá học:
Có nA = n↓ nên
Vậy trường hợp 2 không thỏa mãn.
Vậy hai halogen là fluorine và chlorine.
Đề thi học kì 2 Hóa học lớp 10 Chân trời sáng tạo có đáp án - Đề 2
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2 - Chân trời sáng tạo
Năm học .................
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 2)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của nitrogen trong hợp chất KNO3 là
A. +3. B. +5.
C. +7. D. +2.
Câu 2: Cho các phát biểu sau:
(a) Số oxi hoá của nguyên tử trong các đơn chất bằng 0.
(b) Số oxi hoá của kim loại kiềm trong hợp chất là +1.
(c) Số oxi hoá của oxygen trong OF2 là -2.
(d) Trong hợp chất, hydrogen luôn có số oxi hoá là +1.
Số phát biểu đúng là
A. 1. B. 2.
C. 3. D. 4.
Câu 3: Cho các phản ứng hoá học sau:
(b) 2HCl + Na2CO3 → 2NaCl + CO2 + H2O.
(c) 2HCl + Fe → FeCl2 + H2.
(d) 4HCl + MnO2 → MnCl2 + Cl2 + 2H2O.
Số phản ứng oxi hoá – khử là
A. 4. B. 3.
C. 2. D. 1.
Câu 4: Nguyên tử sulfur chỉ thể hiện tính khử (trong điều kiện phản ứng phù hợp) trong hợp chất nào sau đây?
A. SO2. B. H2SO4.
C. H2S. D. Na2SO3.
Câu 5: Cho phương trình nhiệt hóa học của phản ứng:
CuSO4(aq) + Zn(s) → ZnSO4(aq) + Cu(s)
Phản ứng trên là phản ứng
A. thu nhiệt.
B. tỏa nhiệt.
C. không có sự thay đổi năng lượng.
D. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
Câu 6: Dựa vào phương trình nhiệt hóa học của phản ứng sau:
A. – 546 kJ.
B. + 546 kJ.
C. – 273 kJ.
D. + 273 kJ.
Câu 7: Những ngày nóng nực, pha viên sủi vitamin C vào nước để giải khát, khi viên sủi tan, thấy nước trong cốc mát hơn đó là do
A. xảy ra phản ứng tỏa nhiệt.
B. xảy ra phản ứng thu nhiệt.
C. xảy ra phản ứng trao đổi chất với môi trường.
D. có sự giải phóng nhiệt lượng ra ngoài môi trường.
Câu 8: Nhiệt lượng tỏa ra hay thu vào của phản ứng ở điều kiện áp suất không đổi gọi là
A. nhiệt tạo thành chuẩn của phản ứng.
B. biến thiên enthalpy của phản ứng.
C. enthalpy của phản ứng.
D. năng lượng của phản ứng.
Câu 9: Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) ⟶ CO2(g) + 2H2O(l) = – 890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là – 393,5 và – 285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
A. – 74,8 kJ.
B. 74,8 kJ.
C. – 211,6 kJ.
D. 211,6 kJ.
Câu 10: Cho phản ứng sau:
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là
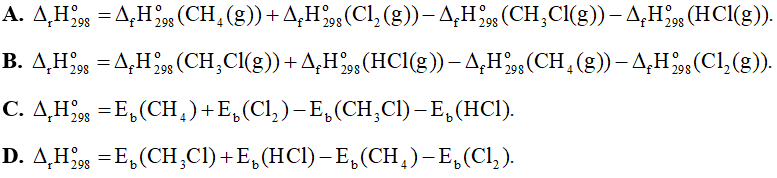
Câu 11: Tốc độ trung bình của phản ứng là
A. tốc độ phản ứng tại một thời điểm nào đó.
B. tốc độ được tính trong một khoảng thời gian phản ứng.
C. biến thiên nồng độ của phản ứng.
D. biến thiên khối lượng của phản ứng.
Câu 12: Cho phản ứng hoá học:
Zn(s) + 2HCl(aq) → ZnCl2(aq) + H2(g)
Sau 40 giây, nồng độ của HCl giảm từ 0,6M về 0,4M. Tốc độ trung bình của phản ứng theo nồng độ HCl trong 40 giây là
A. 1,5 × 10-3 M/s.
B. 1,0 × 10-3 M/s.
C. 2,5 × 10-3 M/s.
D. 2,0 × 10-3 M/s.
Câu 13: Cho phản ứng đơn giản sau:
CHCl3(g) + Cl2(g) → CCl4(g) + HCl(g)
Biểu thức tốc độ tức thời của phản ứng viết theo định luật tác dụng khối lượng là
A. v =
B. v =
C. v =
D. v =
Câu 14: Phát biểu nào sau đây không đúng?
A. Ở nhiệt độ không đổi, tốc độ phản ứng tỉ lệ với tích số nồng độ các chất tham gia phản ứng với số mũ thích hợp.
B. Tốc độ phản ứng có thể nhận giá trị dương hoặc âm.
C. Tốc độ tức thời của phản ứng là tốc độ phản ứng tại một thời điểm nào đó.
D. Tốc độ phản ứng đốt cháy cồn (alcohol) lớn hơn tốc độ của phản ứng gỉ sắt.
Câu 15: Dùng bình chứa oxygen thay cho dùng không khí để đốt cháy acetylene. Yếu tố ảnh hưởng đến tốc độ của quá trình biến đổi này là
A. áp suất.
B. nhiệt độ.
C. nồng độ.
D. chất xúc tác.
Câu 16: Khi nhiệt độ tăng thêm 10oC, tốc độ phản ứng hoá học tăng thêm 2 lần. Tốc độ phản ứng sẽ giảm đi bao nhiêu lần nhiệt khi nhiệt độ giảm từ 70oC xuống 40oC?
A. 8. B. 16.
C. 32. D. 64.
Câu 17: Các enzyme là chất xúc tác, có chức năng:
A. Giảm năng lượng hoạt hóa của phản ứng.
B. Tăng năng lượng hoạt hóa của phản ứng.
C. Tăng nhiệt độ của phản ứng.
D. Giảm nhiệt độ của phản ứng.
Câu 18: Khí oxygen được điều chế trong phòng thí nghiệm bằng cách nhiệt phân potassium chlorate với xúc tác manganes dioxide. Để thí nghiệm thành công và rút ngắn thời gian tiến hành có thể dùng một số biện pháp sau:
(1) Trộn đều bột potassium chlorate và xúc tác.
(2) Nung ở nhiệt độ cao.
(3) Dùng phương pháp dời nước để thu khí oxygen.
(4) Nghiền nhỏ potassium chlorate.
Số biện pháp dùng để tăng tốc độ phản ứng là
A. 2. B. 3.
C. 4. D. 5.
Câu 19: Vị trí nhóm halogen trong bảng tuần hoàn là
A. Nhóm VA.
B. Nhóm VIA.
C. Nhóm VIIA.
D. Nhóm IVA.
Câu 20: Nguyên tử chlorine không có khả năng thể hiện số oxi hoá
A. +3. B. 0.
C. +1. D. +2.
Câu 21: Chất nào dưới đây có sự thăng hoa khi đun nóng?
A. Cl2. B. I2.
C. Br2 . D. F2.
Câu 22: Cho các phát biểu sau:
(a) Trong các phản ứng hóa học, fluorine chỉ thể hiện tính oxi hóa.
(b) Hydrofluoric acid là acid yếu.
(c) Trong hợp chất, các halogen (F, Cl, Br, I) đều có số oxi hóa: -1, +1, +3, +5 và +7.
(d) Tính khử của các ion halogenua tăng dần theo thứ tự: F–, Cl–, Br–, I–.
Trong các phát biểu trên, số phát biểu đúng là
A. 2. B. 4.
C. 3. D. 5.
Câu 23: Cho phản ứng tổng quát sau:
X2(g) + 2KBr(aq) → 2KX(aq) + Br2(aq)
X có thể là chất nào sau đây?
A. Cl2. B. I2.
C. F2. D. O2.
Câu 24: Chọn phương trình phản ứng đúng?
A. Fe + 2HCl → FeCl2 + H2.
B. 2Fe + 6HCl → 2FeCl3 + 3H2.
C. 3Fe + 8HCl → FeCl2 + 2FeCl3 + 4H2.
D. Cu + 2HCl → CuCl2 + H2.
Câu 25: Liên kết trong hợp chất hydrogen halide là
A. liên kết cộng hóa trị không phân cực.
B. liên kết cho – nhận.
C. liên kết ion.
D. liên kết cộng hóa trị phân cực.
Câu 26: Hydrohalic acid nào sau đây được dùng để khắc hoa văn lên thuỷ tinh?
A. Hydrochloric acid.
B. Hydrofluoric acid.
C. Hydrobromic acid.
D. Hydroiodic acid.
Câu 27: Phản ứng giữa chất nào sau đây với dung dịch H2SO4 đặc, nóng không phải là phản ứng oxi hóa – khử?
A. NaBr. B. KI.
C. NaCl. D. NaI.
Câu 28: Hoá chất dùng để phân biệt hai dung dịch NaI và KCl là
A. Na2CO3. B. AgCl.
C. AgNO3. D. NaOH.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Lập phương trình hoá học của phản ứng oxi hoá – khử sau theo phương pháp thăng bằng electron (chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử).
a) Cl2 + KOH KCl + KClO3 + H2O
b) KI + H2SO4 → I2 + H2S + K2SO4 + H2O
Câu 2 (1 điểm): Cho nhiệt độ sôi của các halogen như sau:
|
Halogen |
F2 |
Cl2 |
Br2 |
I2 |
|
Nhiệt độ sôi (oC) |
-188 |
-35 |
59 |
184 |
Giải thích sự biến đổi nhiệt độ sôi từ fluorine đến iodine.
Câu 3 (1 điểm): Cho 1,49 gam hỗn hợp X gồm: MgCO3 và Zn vào một lượng vừa đủ dung dịch HCl. Sau phản ứng thu được dung dịch A và 0,4958 lít khí B ở đkc. Xác định % khối lượng của các chất trong X.
Hướng dẫn giải đề số 2
|
1 - B |
2 - B |
3 - C |
4 - C |
5 - B |
6 - C |
7 - B |
8 - B |
9 - A |
10 - C |
|
11 - B |
12 - C |
13 - A |
14 - B |
15 - C |
16 - A |
17 - A |
18 - B |
19 - C |
20 - D |
|
21 - B |
22 - C |
23 - A |
24 - A |
25 - D |
26 - B |
27 - C |
28 - C |
|
|
Câu 9:
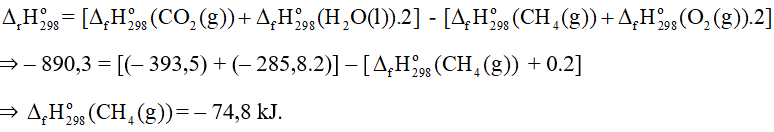
Câu 12:
Tốc độ trung bình của phản ứng theo nồng độ HCl trong 40 giây là
Câu 16:
Áp dụng công thức:
Như vậy khi nhiệt độ giảm từ 70oC xuống 40oC thì tốc độ phản ứng giảm 8 lần.
Phần II: Tự luận
Câu 1:
a)
Cl2 vừa là chất khử, vừa là chất oxi hoá.
Ta có các quá trình:
Quá trình oxi hoá:
Quá trình khử:
Phương trình được cân bằng:
3Cl2 + 6KOH 5KCl + KClO3 + 3H2O
b)
Chất khử: KI.
Chất oxi hoá: H2SO4.
Quá trình oxi hoá:
Quá trình khử:
Phương trình được cân bằng:
8KI + 5H2SO4 → 4I2 + H2S + 4K2SO4 + 4H2O
Câu 2:
Từ fluorine đến iodine, khối lượng phân tử và bán kính nguyên tử tăng, làm tăng tương tác van der Waals dẫn đến nhiệt độ sôi tăng.
Câu 3:
nB = = 0,02 mol
Gọi số mol MgCO3 là x (mol), số mol Zn là y (mol).
Phương trình hoá học:
MgCO3 + 2HCl → MgCl2 + CO2 + H2O
x 2x x x mol
Zn + 2HCl → ZnCl2 + H2
y 2y y y mol
Ta có hệ phương trình:
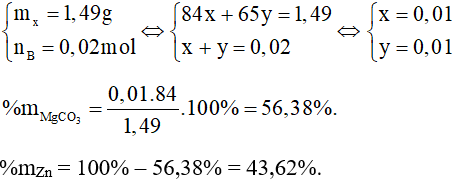
Đề thi học kì 2 Hóa học lớp 10 Chân trời sáng tạo có đáp án - Đề 3
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2 - Chân trời sáng tạo
Năm học .................
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 3)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của chlorine trong hợp chất HClO là
A. +1. B. -1.
C. +2. D. -2.
Câu 2: Nhận định nào sau đây là sai?
A. Số oxi hoá được đặt ở phía trên kí hiệu của nguyên tố.
B. Số oxi hoá của nguyên tử trong các đơn chất bằng 0.
C. Oxygen trong mọi hợp chất đều có số oxi hoá là -2.
D. Hydrogen trong hydride có số oxi hoá là -1.
Câu 3: Cho phản ứng hoá học sau:
2H2S + 3O2 → 2SO2 + 2H2O
Trong phản ứng này, chất khử là
A. H2S. B. O2.
C. SO2. D. H2O.
Câu 4: Trong phản ứng tạo thành calcium chloride từ đơn chất: Ca + Cl2 → CaCl2.
Kết luận nào sau đây đúng?
A. Mỗi nguyên tử calcium nhường 1 electron.
B. Mỗi nguyên tử chlorine nhận 2 electron.
C. Mỗi phân tử chlorine nhận 1 electron.
D. Mỗi nguyên tử calcium nhường 2 electron.
Câu 5: Cho phương trình nhiệt hóa học của phản ứng:
Phản ứng trên là phản ứng
A. thu nhiệt.
B. tỏa nhiệt.
C. không có sự thay đổi năng lượng.
D. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
Câu 6: Phản ứng nào sau đây là phản ứng thu nhiệt?
A. Phản ứng xảy ra khi đốt cháy cồn.
B. Phản ứng phân hủy đá vôi (CaCO3).
C. Phản ứng đốt cháy khí hydrogen trong không khí.
D. Phản ứng đốt cháy khí methane (CH4).
Câu 7: Cho các phát biểu sau:
(1). Tất cả các phản ứng cháy đều thu nhiệt.
(2). Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(3). Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều toả nhiệt.
(4). Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
Số phát biểu sai là
A. 1. B. 2.
C. 3. D. 4.
Câu 8: Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất được kí hiệu là
A. . B. ∆fH.
C. . D. ∆rH.
Câu 9: Cho phản ứng tổng quát: aA + bB → mM + nN. Phương án tính đúng của phản ứng là
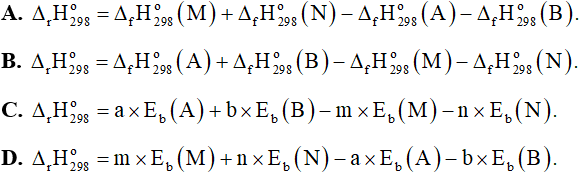
Câu 10: Cho phản ứng sau:
4Na(s) + O2(g) → 2Na2O(s)
Enthalpy tạo thành của Na2O rắn ở điều kiện chuẩn là
A. – 836 kJ/ mol.
B. + 836 kJ/ mol.
C. – 418 kJ/ mol.
D. + 418 kJ/ mol.
Câu 11: Tốc độ trung bình của phản ứng là
A. tốc độ được tính tại một thời điểm nào đó.
B. tốc độ được tính trong một khoảng thời gian phản ứng.
C. tốc độ được tính theo định luật tác dụng khối lượng.
D. tốc độ của phản ứng sau 1 phút.
Câu 12: Cho phản ứng tổng quát sau: aA + bB → cC + dD.
Biểu thức tính tốc độ trung bình của phản ứng đúng là
A.
B.
C.
D.
Câu 13: Phản ứng 3H2(g) + N2(g) → 2NH3(g) có tốc độ mất đi của N2 so với tốc độ hình thành NH3 là
A. bằng .
B. bằng .
C. bằng .
D. bằng .
Câu 14: Cho phản ứng đơn giản xảy ra trong bình kín: 3H2(g) + N2(g) ⟶ 2NH3(g).
Tốc độ phản ứng thay đổi như thế nào nếu nồng độ N2 không đổi và nồng độ H2 tăng 2 lần?
A. Tăng 2 lần.
B. Tăng 4 lần.
C. Tăng 8 lần.
D. Tăng 6 lần.
Câu 15: Khi nồng độ chất tham gia phản ứng càng lớn thì
A. tốc độ phản ứng càng lớn.
B. tốc độ phản ứng càng giảm.
C. tốc độ phản ứng không thay đổi.
D. tốc độ phản ứng biến thiên liên tục.
Câu 16: Chất xúc tác là
A. chất làm giảm tốc độ phản ứng hoá học.
B. chất làm tăng tốc độ phản ứng và bị tiêu biến sau khi phản ứng kết thúc.
C. chất làm tăng tốc độ phản ứng nhưng vẫn được bảo toàn về chất và lượng khi kết thúc phản ứng.
D. chất làm giảm tốc độ phản ứng nhưng vẫn được bảo toàn về chất và lượng khi kết thúc phản ứng.
Câu 17: Nhận định nào sau đây là đúng?
A. Khi đốt than trong lò, đậy nắp lò sẽ khiến than cháy nhanh hơn.
B. Que đóm cháy trong bình khí oxygen chậm hơn so với cháy ngoài không khí.
C. Khi nhóm bếp củi, dùng củi được chẻ nhỏ sẽ nhóm bếp nhanh hơn.
D. Thêm MnO2 vào quá trình nhiệt phân KClO3 sẽ làm giảm lượng O2 thu được.
Câu 18: Một phản ứng có hệ số nhiệt độ Van’t Hoff bằng 3. Ở 25°C, tốc độ của phản ứng này bằng 0,2 M s-1. Tốc độ của phản ứng ở 45°C là
A. 0,6 M s-1.
B. 1,2 M s-1.
C. 1,8 M s-1.
D. 2,4 M s-1.
Câu 19: Nguyên tố halogen nào sau đây là nguyên tố phóng xạ?
A. Fluorine.
B. Chlorine.
C. Bromine.
D. Astatine.
Câu 20: Số electron lớp ngoài cùng của nguyên tử các nguyên tố halogen là
A. 5. B. 7.
C. 1. D. 3.
Câu 21: Chất nào sau đây được dùng làm chất tẩy màu và sát trùng?
A. Hydrochloric acid.
B. Sodium chloride.
C. Nước Javel.
D. Iodine.
Câu 22: Cho các phương trình hóa học sau:
(a) Cl2 + 2NaBr → 2NaCl + Br2
(b) F2 + 2NaCl → 2NaF + Cl2
(c) HF + AgNO3 → AgF + HNO3
(d) HCl + AgNO3 → AgCl + HNO3
Số phương trình hóa học viết đúng là
A. 4. B. 1.
C. 2. D. 3.
Câu 23: Trong y tế, đơn chất halogen nào được hòa tan trong ethanol để dùng làm chất sát trùng vết thương?
A. Cl2. B. F2.
C. I2. D. Br2.
Câu 24: Kim loại tác dụng được với acid HCl và khí chlorine cho cùng một loại muối chloride kim loại là
A. iron (Fe).
B. magnesium (Mg).
C. copper (Cu).
D. silver (Ag).
Câu 25: Hoá chất dùng để nhận biết 4 dung dịch: NaF, NaCl, NaBr, NaI là
A. NaOH.
B. H2SO4.
C. AgNO3.
D. Ag.
Câu 26: Cho dãy dung dịch acid sau: HF, HCl, HBr, HI. Dung dịch có tính acid mạnh nhất là
A. HF . B. HCl.
C. HBr. D. HI.
Câu 27: Phản ứng chứng tỏ HCl có tính khử là
A. HCl + NaOH → NaCl + H2O.
B. 2HCl + Mg → MgCl2 + H2 .
C. MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O.
D. NH3 + HCl → NH4Cl.
Câu 28: Cho phản ứng: NaX(khan) + H2SO4 (đậm đặc) NaHSO4 + HX(khí).
Các hydrogen halide có thể điều chế theo phản ứng trên là
A. HCl, HBr và HI .
B. HBr và HI.
C. HF và HCl.
D. HF, HCl, HBr và HI.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Lập phương trình hoá học của phản ứng oxi hoá – khử sau theo phương pháp thăng bằng electron (chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử).
a) Cl2 + KOH KCl + KClO3 + H2O.
b) KI + H2SO4 I2 + S + K2SO4 + H2O.
Câu 2 (1 điểm): Cho hỗn hợp X gồm 1,4 gam Fe và 1,6 gam Cu phản ứng hoàn toàn với một lượng khí Cl2 dư. Kết thúc phản ứng thấy thu được m gam muối. Tính m và thể tích khí Cl2 ở đkc cần dùng để phản ứng hết với lượng kim loại trên.
Câu 3 (1 điểm): Cho 3,68 gam hỗn hợp gồm Al và Zn tác dụng với một lượng vừa đủ dung dịch HCl 10%, thu được 2,479 lít khí H2 (ở đkc).
a/ Xác định % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b/ Tính nồng độ % các muối có trong dung dịch sau phản ứng
Đề thi học kì 2 Hóa học lớp 10 Chân trời sáng tạo có đáp án - Đề 4
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 2 - Chân trời sáng tạo
Năm học .................
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 4)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hoá của S trong ion là
A. +2. B. +4.
C. +6. D. +7.
Câu 2: Cho các chất sau: NaNO3; (NH4)2CO3; NH3; N2O3; N2O5. Số trường hợp nitrogen có số oxi hoá +5 là
A. 4. B. 2.
C. 1. D. 3.
Câu 3: Phản ứng nào sau đây là phản ứng oxi hoá – khử?
A. Na2CO3 + 2HCl → 2NaCl + CO2 + H2O.
B. KOH + HCl → KCl + H2O.
C. CaO + CO2 CaCO3.
D. 3CO + Fe2O3 3CO2 + 2Fe.
Câu 4: Trong phản ứng: 3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O. Số phân tử nitric acid (HNO3) đóng vai trò chất oxi hóa là
A. 8. B. 6.
C. 4. D. 2.
Câu 5: Cho các phản ứng hoá học sau:
(1) Phản ứng đốt cháy khí gas.
(2) Phản ứng nhiệt nhôm.
(3) Phản ứng nhiệt phân potassium chlorate (KClO3).
(4) Phản ứng nung đá vôi (CaCO3).
Phản ứng toả nhiệt là
A. (1) và (3). B. (1) và (4).
C. (1) và (2). D. (3) và (4).
Câu 6: Phản ứng thu nhiệt là
A. phản ứng hoá học trong đó có sự giải phóng nhiệt năng ra môi trường.
B. phản ứng có ∆rH < 0.
C. phản ứng hoá học trong đó có sự hấp thụ nhiệt năng từ môi trường.
D. phản ứng có ∆rH = 0.
Câu 7: Cho các nhận xét sau:
(a) Biến thiên enthalpy chuẩn của một phản ứng hoá học được kí hiệu là
(b) Điều kiện chuẩn là điều kiện ứng với áp suất 1 atm đối với chất khí.
(c) Enthalpy tạo thành trong điều kiện chuẩn được gọi là enthalpy tạo thành chuẩn.
(d) Enthalpy tạo thành chuẩn của đơn chất ở dạng bền nhất bằng 0.
Số phát biểu đúng là
A. 1. B. 2.
C. 3. D. 4.
Câu 8: Cho phương trình nhiệt hoá học sau:
CH4(g) + 2O2(g) CO2(g) + 2H2O(l)
Nhiệt lượng giải phóng ra khí đốt cháy hoàn toàn 2,479 lít CH4 ở điều kiện chuẩn là
A. 890 kJ. B. 89 kJ.
C. – 890 kJ. D. – 89 kJ.
Câu 9: Cho phản ứng sau: CaCO3(s) → CaO(s) + CO2(g) . Biến thiên enthalpy chuẩn của phản ứng được tính theo công thức là
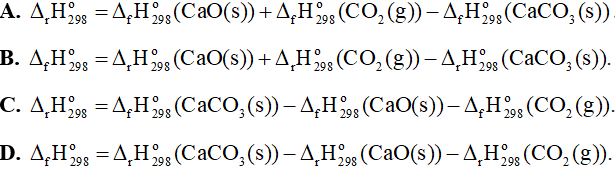
Câu 10: Cho phản ứng:
H2(g) + Cl2(g) → 2HCl(g)
Trong các phát biểu sau:
(a) Biến thiên enthalpy chuẩn của phản ứng trên là – 184,6 kJ.
(b) Biến thiên enthalpy chuẩn của phản ứng trên là – 92,3 kJ.
(c) Nhiệt tạo thành chuẩn của HCl(g) là – 92,3 kJ.
(d) Nhiệt tạo thành chuẩn của HCl(g) là 92,3 kJ.
Số phát biểu đúng là
A. 1. B. 2.
C. 3. D. 4.
Câu 11: Cho các phát biểu sau về tốc độ phản ứng:
(a) Tốc độ phản ứng hoá học dùng để đánh giá mức độ xảy ra nhanh hay chậm của một phản ứng.
(b) Tốc độ trung bình của phản ứng là tốc độ phản ứng tại một thời điểm nào đó.
(c) Đơn vị tốc độ phản ứng là mol/ lít.
(d) Tốc độ tức thời của phản ứng là tốc độ được tính trong một khoảng thời gian phản ứng.
Số phát biểu sai là
A. 4. B. 3.
C. 2. D. 1.
Câu 12: Cho phản ứng hoá học sau: Fe(s) + 2HCl(aq) → FeCl2(aq) + H2(g).
Sau 40 giây, nồng độ của dung dịch HCl giảm từ 0,8M về 0,6M. Tốc độ trung bình của phản ứng tính theo nồng độ HCl trong 40 giây là
A. 5.10-3 M/s. B. 2,5.10-3 M/s.
C. 2.10-3 M/s. D. 1,5.10-3 M/s.
Câu 13: Cho phương trình tổng hợp ammonia (NH3):
N2(g) + 3H2(g) → 2NH3(g)
Nếu tốc độ tạo thành NH3 là 0,345 M/s thì tốc độ của chất phản ứng N2 là
A. 0,345 M/s.
B. 0,690 M/s.
C. 0,173 M/s.
D. 0,518 M/s.
Câu 14: Để hạn chế sự ôi thiu thực phẩm do các phản ứng của oxygen cũng như sự hoạt động của vi khuẩn, người ta thường bơm khí nào sau đây vào các túi đựng thực phẩm trước khi đóng gói?
A. O2.
B. N2.
C. CO2.
D. N2 hoặc CO2.
Câu 15: Xét phản ứng đơn giản sau:
CO(g) + H2O(g) → CO2(g) + H2(g)
Biểu thức tốc độ tức thời của phản ứng viết theo định luật tác dụng khối lượng là
B. v =
C. v =
D. v =
Câu 16: Khi cho cùng một lượng kẽm (zinc) vào cốc đựng dung dịch acid HCl, tốc độ phản ứng sẽ lớn nhất khi dùng kẽm ở dạng nào sau đây?
A. Viên nhỏ.
B. Bột mịn, khuấy đều.
C. Lá mỏng.
D. Thỏi lớn.
Câu 17: Cho các yếu tố sau: nồng độ, nhiệt độ, áp suất, diện tích bề mặt, chất xúc tác. Trong những yếu tố trên, có bao nhiêu yếu tố ảnh hưởng đến tốc độ phản ứng?
A. 2. B. 3.
C. 4. D. 5.
Câu 18: Phản ứng của H2 với I2 là phản ứng đơn giản:
H2(g) + I2(g) → 2HI(g)
Nếu nồng độ của các chất tham gia phản ứng đều tăng gấp đôi, thì
A. tốc độ phản ứng không thay đổi.
B. tốc độ phản ứng tăng hai lần.
C. tốc độ phản ứng giảm hai lần.
D. tốc độ phản ứng tăng bốn lần.
Câu 19: Nguyên tố nào sau đây có cấu hình electron lớp ngoài cùng là 3s23p5?
A. Chlorine.
B. Fluorine.
C. Bromine.
D. Sulfur.
Câu 20: Halogen ở trạng thái rắn điều kiện thường là
A. Fluorine.
B. Chlorine.
C. Bromine.
D. Iodine.
Câu 21: Trong các đơn chất: F2, Cl2, Br2, I2, chất có nhiệt độ nóng chảy và nhiệt độ sôi cao nhất là
A. F2. B. Cl2.
C. Br2. D. I2.
Câu 22: Đặc điểm của halogen là
A. nguyên tử chỉ nhận thêm 1 electron trong các phản ứng hóa học.
B. tạo liên kết cộng hóa trị với nguyên tử hydrogen.
C. nguyên tử có số oxi hóa –1 trong tất cả hợp chất.
D. nguyên tử có 5 electron hóa trị.
Câu 23: Phương trình hoá học nào sau đây là sai?
A. Fe + Cl2 FeCl2.
B. 6NaOH + 3Cl2 5NaCl + NaClO3 + 3H2O.
C. SiO2 + 4HF → SiF4 + 2H2O.
D. 2F2 + 2H2O → 4HF + O2.
Câu 24: Cho các phát biểu sau:
(a) Iodine là nguyên tố đa lượng cần thiết cho dinh dưỡng của con người.
(b) Từ fluorine đến iodine màu sắc halogen đậm dần.
(c) Nhiệt độ sôi của các hydrogen halide tăng dần từ HF đến HI.
(d) Hydrofluoric acid (HF) là acid mạnh.
Số phát biểu sai là
A. 4. B. 3.
C. 2. D. 1.
Câu 25: Phân tử có tương tác van der Waals lớn nhất là
A. HCl. B. HI.
C. HBr. D. HF.
Câu 26: Hydrogen halide nào sau đây được dùng để tẩy cặn trong các thiết bị trao đổi nhiệt; chất xúc tác trong các nhà máy lọc dầu, công nghệ làm giàu uranium, sản xuất dược phẩm …
A. Hydrogen fluoride.
B. Hydrogen chloride.
C. Hydrogen bromide.
D. Hydrogen iodide.
Câu 27: Dung dịch dùng để nhận biết các ion halide là
A. Quỳ tím. B. AgNO3.
C. NaOH. D. HCl.
Câu 28: Kim loại nào sau đây không tác dụng với acid HCl?
A. Al. B. Zn.
C. Cu. D. Mg.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Lập phương trình hoá học của phản ứng oxi hoá – khử sau theo phương pháp thăng bằng electron (chỉ rõ chất khử, chất oxi hoá, quá trình oxi hoá, quá trình khử).
a) KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O.
b) KI + H2SO4 → I2 + SO2 + K2SO4 + H2O.
Câu 2 (1 điểm): Cho biết nhiệt độ nóng chảy của các halogen như sau:
|
Halogen |
F2 |
Cl2 |
Br2 |
I2 |
|
Nhiệt độ nóng chảy (toC) |
-220 |
-101 |
-7 |
114 |
Giải thích sự biến đổi nhiệt độ nóng chảy từ fluorine đến iodine.
Câu 3 (1 điểm): Hoà tan hỗn hợp bột gồm m gam Cu và 4,64 gam Fe3O4 vào dung dịch HCl rất dư, sau khi các phản ứng kết thúc chỉ thu được dung dịch X. Dung dịch X làm mất màu vừa đủ 50 ml dung dịch KMnO4 0,1M. Tính giá trị của m.