Tailieumoi.vn xin giới thiệu bộ đề thi học kì 1 môn Hóa học lớp 10 sách Chân trời sáng tạo năm 2024 – 2025. Tài liệu gồm 4 đề thi có ma trận chuẩn bám sát chương trình học và đáp án chi tiết, được biên soạn bởi đội ngũ giáo viên THPT dày dặn kinh nghiệm sẽ giúp các em ôn tập kiến thức và rèn luyện kĩ năng nhằm đạt điểm cao trong bài thi học kì 1 Hóa học 10. Mời các bạn cùng đón xem:
Chỉ từ 100k mua trọn bộ Đề thi học kì 1 Hóa học 10 Chân trời sáng tạo bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
A. Ma trận đề thi Học kì 1 Hóa học lớp 10 (Chân trời sáng tạo)
- Thời điểm kiểm tra: Kiểm tra học kì 1 khi kết thúc nội dung: Liên kết hóa học.
- Thời gian làm bài: 45 phút.
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 70% trắc nghiệm, 30% tự luận).
- Cấu trúc:
+ Mức độ đề: 40 % Nhận biết; 30 % Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
+ Phần trắc nghiệm: 7,0 điểm, (gồm 28 câu hỏi: nhận biết: 16 câu, thông hiểu: 12 câu), mỗi câu 0,25 điểm;
+ Phần tự luận: 3,0 điểm (Vận dụng: 2,0 điểm; Vận dụng cao: 1,0 điểm).
+ Nội dung nửa đầu học kì 1: 25% (2,5 điểm)
+ Nội dung nửa học kì sau: 75% (7,5 điểm)
Đề thi học kì 1 Hóa học lớp 10 Chân trời sáng tạo có đáp án năm 2024 - 2025 - Đề 1
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1 - Chân trời sáng tạo
Năm học 2024 - 2025
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của Hóa học?
A. Sự vận chuyển của máu trong hệ tuần hoàn.
B. Cấu tạo của chất và sự biến đổi của chất.
C. Tốc độ của ánh sáng trong chân không.
D. Sự tự quay của Trái Đất quanh trục riêng.
Câu 2: Thông tin nào sau đây không đúng?
A. Proton mang điện tích dương, nằm trong hạt nhân.
B. Nguyên tử trung hòa về điện.
C. Proton và electron có khối lượng gần bằng nhau.
D. Nguyên tử có cấu trúc rỗng.
Câu 3: Một nguyên tử được đặc trưng cơ bản bằng
A. số proton và số đơn vị điện tích hạt nhân.
B. số proton và số electron.
C. số khối và số neutron.
D. số khối và số đơn vị điện tích hạt nhân.
Câu 4: Cho những nguyên tử của các nguyên tố sau:
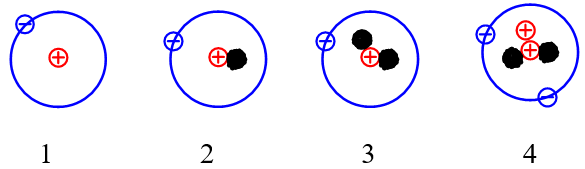
Những nguyên tử nào sau đây là đồng vị của nhau?
A. 1 và 2.
B. 2 và 3.
C. 1, 2 và 3.
D. 1, 2, 3 và 4.
Câu 5: Hình ảnh dưới đây là hình dạng của loại orbital nguyên tử nào?
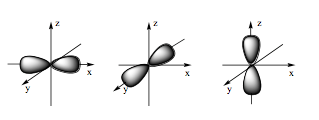
A. Orbital s.
B. Orbital p.
C. Orbital d.
D. Orbital f.
Câu 6: Electron thuộc lớp nào sau đây liên kết chặt chẽ nhất với hạt nhân?
A. Lớp N.
B. Lớp L.
C. Lớp M.
D. Lớp K.
Câu 7: Nguyên tử nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của X là
A. [Ne] 3s23p2.
B. [Ne] 3s23d2.
C. [He] 3s23p2.
D. [Ar] 3s23p2.
Câu 8: Ở trạng thái cơ bản, nguyên tử aluminium (Al) có số electron độc thân là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 9: Số hiệu nguyên tử của nguyên tố hóa học bằng
A. số thứ tự của ô nguyên tố.
B. số thứ tự của chu kì.
C. số thứ tự của nhóm.
D. số electron lớp ngoài cùng của nguyên tử.
Câu 10: Chu kì 4 của bảng hệ thống tuần hoàn có
A. 2 nguyên tố.
B. 18 nguyên tố.
C. 32 nguyên tố.
D. 8 nguyên tố.
Câu 11: Trong các nhóm A, sự biến thiên tính chất của các nguyên tố thuộc chu kì sau lại lặp lại giống như chu kì trước (biến đổi tuần hoàn) là do
A. sự lặp lại tính kim loại của các nguyên tố ở chu kì sau so với chu kì trước.
B. sự lặp lại tính phi kim của các nguyên tố ở chu kì sau so với chu kì trước.
C. sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước.
D. sự lặp lại tính chất hóa học của các nguyên tố ở chu kì sau so với chu kì trước.
Câu 12: Trong một chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện thường
A. giảm xuống.
B. tăng dần.
C. biến đổi không theo quy luật.
D. không thay đổi.
Câu 13: Cho các nguyên tố O (Z = 8), F (Z = 9), Si (Z = 14), S (Z = 16). Nguyên tố có tính phi kim lớn nhất trong số các nguyên tố trên là
A. O.
B. F.
C. S.
D. Si.
Câu 14: X là nguyên tố nhóm IA. Công thức oxide ứng với hóa trị cao nhất của X là
A. XO.
B. XO2.
C. X2O.
D. X2O3.
Câu 15: Nguyên tố X ở chu kì 3, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s²2s²2p6.
B. 1s²2s²2p3s²3p¹.
C. 1s²2s²2p3s³.
D. 1s²2s²2p63s².
Câu 16: Nguyên tố X thuộc nhóm IA, còn nguyên tố Z thuộc nhóm VIIA của bảng tuần hoàn. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố X, Z lần lượt là
A. ns1 và ns2np5.
B. ns1 và ns2np7.
C. ns1 và ns2np3.
D. ns2 và ns2np5.
Câu 17: Liên kết hóa học là
A. sự kết hợp giữa các hạt cơ bản hình thành nguyên tử bền vững.
B. sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
C. sự kết hợp của các phân tử hình thành các chất bền vững.
D. sự kết hợp của chất tạo thành vật thể bền vững.
Câu 18: Để lớp vỏ thỏa mãn quy tắc octet, nguyên tử oxygen (Z = 8) có xu hướng
A. nhường 6 electron
B. nhận 2 electron
C. nhường 8 electron
D. nhận 6 electron
Câu 19: Khi nguyên tử nhận electron sẽ tạo thành
A. phân tử.
B. ion.
C. cation.
D. anion.
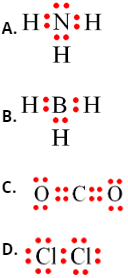
Câu 20: Chất nào sau đây là hợp chất ion?
A. SO2.
B. CO2.
C. K2O.
D. HCl.
Câu 21: Liên kết cộng hoá trị thường được hình thành giữa
A. các nguyên tử nguyên tố kim loại với nhau.
B. các nguyên tử nguyên tố phi kim với nhau.
C. các nguyên tử nguyên tố kim loại với các nguyên tố phi kim.
D. các nguyên tử khí hiếm với nhau.
Câu 22: Cho các hợp chất sau: Na2O; H2O; HCl; Cl2; O3; CH4. Có bao nhiêu chất mà trong phân tử chứa liên kết cộng hóa trị phân cực?
A. 2.
B. 3.
C. 5.
D. 6.
Câu 23: Số lượng cặp electron dùng chung trong các phân tử O2, N2, F2 lần lượt là
A. 2, 3, 4
B. 2, 3, 1
C. 2, 2, 2
D. 2, 2, 1
Câu 24: Cấu hình electron ở lớp ngoài cùng của nguyên tử nguyên tố X là 3s23p5. Liên kết của nguyên tử này với nguyên tử hydrogen thuộc loại liên kết nào sau đây?
A. Liên kết cộng hóa trị không cực.
B. Liên kết cộng hóa trị có cực.
C. Liên kết ion.
D. Liên kết kim loại.
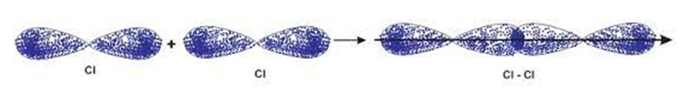
Câu 25: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p-p ?
A. H2.
B. NH3.
C. HCl.
D. Cl2.
Câu 26: Nhóm chất nào sau đây có liên kết “cho – nhận”?
A. KCl, CO2.
B. HBr, MgCl2.
C. H2O, HCl.
D. NH4Cl, CO.
Câu 27: Cho các phát biểu sau
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hóa trị.
(c) Tương tác van der Waals yếu hơn liên kết hydrogen.
(d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
Phát biểu đúng là
A. (a) và (c).
B. (a) và (d).
C. (b) và (c).
D. (b) và (d).
Câu 28: Chất nào sau đây không thể tạo được liên kết hydrogen?
A. H2O.
B. CH4.
C. CH3OH.
D. NH3.
Phần II: Tự luận (3 điểm)
Câu 29 (1 điểm): Viết cấu hình electron của các ion: K+, Mg2+, F–, S2–. Mỗi cấu hình đó giống với cấu hình electron của nguyên tử khí hiếm nào?
Câu 30 (1 điểm): Dựa vào giá trị độ âm điện, dự đoán loại liên kết (liên kết cộng hóa trị phân cực, liên kết cộng hóa trị không phân cực, liên kết ion) trong các phân tử: MgCl2, AlCl3, HBr, O2, H2 và NH3.
|
Nguyên tử |
Mg |
Al |
H |
N |
Cl |
Br |
O |
|
Độ âm điện |
1,31 |
1,61 |
2,20 |
3,04 |
3,16 |
2,96 |
3,44 |
Câu 31 (1 điểm): Giải thích tại sao ở điều kiện thường, các nguyên tố nhóm halogen như fluorine và chlorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
Đáp án đề thi Học kì 1 môn Hóa học 10 Chân trời sáng tạo - (Đề số 1)
Phần I: Trắc nghiệm
Câu 1:
Đáp án đúng là: B
Hóa học là ngành khoa học thuộc lĩnh vực khoa học tự nhiên, nghiên cứu về thành phần, cấu trúc, tính chất và sự biến đổi của chất cũng như ứng dụng của chúng.
Câu 2:
Đáp án đúng là: C
Phát biểu C không đúng vì hạt electron có khối lượng rất nhỏ so với hạt proton.
Câu 3:
Đáp án đúng là: D
Số đơn vị điện tích hạt nhân nguyên tử (còn gọi là số hiệu nguyên tử) của một nguyên tố hóa học và số khối được xem là những đặc trưng cơ bản của nguyên tử.
Câu 4:
Đáp án đúng là: C
Đồng vị là những nguyên tử có cùng số proton nhưng khác nhau về số neutron dẫn đến số khối của chúng là khác nhau.
Vậy các nguyên tử (1); (2); (3) là đồng vị của nhau do cùng có số proton là 1.
Câu 5:
Đáp án đúng là: B
Orbital p có dạng hình số tám nổi.
Câu 6:
Đáp án đúng là: D
Lớp K, lớp thứ nhất, gần hạt nhân nhất, liên kết chặt chẽ với hạt nhân nhất.
Câu 7:
Đáp án đúng là: A
Cấu hình electron của X: 1s22s22p63s23p2.
Viết gọn: [Ne]3s23p2.
Câu 8:
Đáp án đúng là: A
Cấu hình electron Al theo ô orbital:

Số electron độc thân của nguyên tử Al ở trạng thái cơ bản: 1 electron.
Câu 9:
Đáp án đúng là: A
Số hiệu nguyên tử của nguyên tố hóa học bằng số thứ tự của ô nguyên tố.
Câu 10:
Đáp án đúng là: B
Chu kì 4 của bảng hệ thống tuần hoàn có 18 nguyên tố.
Câu 11:
Đáp án đúng là: C
Trong các nhóm A, sự biến thiên tính chất của các nguyên tố thuộc chu kì sau lại lặp lại giống như chu kì trước (biến đổi tuần hoàn) là do sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước.
Câu 12:
Đáp án đúng là: B
Trong một chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện thường tăng dần.
Câu 13:
Đáp án đúng là: B
|
|
Nhóm IVA |
Nhóm VIA |
Nhóm VIIA |
|
Chu kì 2 |
|
O (Z = 8) |
F (Z = 9) |
|
Chu kì 3 |
Si (Z = 14) |
S (Z = 16) |
|
Theo quy luật biến đổi ta có tính phi kim: Si < S < O < F.
Vây nguyên tố có tính phi kim lớn nhất trong dãy là F.
Câu 14:
Đáp áp đúng là: C
X thuộc nhóm IA nên có hóa trị cao nhất trong hợp chất là I.
Công thức oxide ứng với hóa trị cao nhất của X là X2O.
Câu 15:
Đáp án đúng là: D
X ở chu kì 3 nên có 3 lớp electron.
X ở nhóm IIA nên có 2 electron ở lớp ngoài cùng.
Cấu hình electron của X là: 1s²2s²2p63s².
Câu 16:
Đáp án đúng là: A
X thuộc nhóm IA nên có 1 electron ở lớp ngoài cùng.
Z thuộc nhóm VIIA nên có 7 electron ở lớp ngoài cùng.
Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố X, Z lần lượt là ns1 và ns2np5.
Câu 17:
Đáp án đúng là: B
Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
Câu 18:
Đáp án đúng là: B
O (Z = 8): 1s22s22p4
Nguyên tử O có 6 electron ở lớp ngoài cùng, có xu hướng nhận vào 2 electron để đạt được cấu hình electron bền vững của khí hiếm gần nhất.
Câu 19:
Đáp án đúng là: D
Khi nguyên tử nhận electron sẽ tạo thành phần tử mang điện âm (gọi là anion).
Câu 20:
Đáp án đúng là: C
K2O: hợp chất ion;
SO2; CO2; HCl: hợp chất cộng hóa trị.
Câu 21:
Đáp án đúng là: B
Liên kết cộng hoá trị thường được hình thành giữa các nguyên tử nguyên tố phi kim với nhau.
Câu 22:
Đáp án đúng là: A
Các chất trong phân tử chứa liên kết cộng hóa trị phân cực là: H2O; HCl.
Câu 23:
Đáp án đúng là: B
|
Công thức phân tử |
Công thức cấu tạo |
Số lượng cặp electron chung |
|
O2 |
O = O |
2 |
|
N2 |
N ≡ N |
3 |
|
F2 |
F - F |
1 |
Câu 24:
Đáp án đúng là: B
X thuộc nhóm VIIA, là phi kim mạnh.
Liên kết giữa X với hydrogen là liên kết cộng hóa trị phân cực (có cực).
Câu 25:
Đáp án đúng là: D
Liên kết trong phân tử Cl2 được hình thành nhờ sự xen phủ bên p – p.
Câu 26:
Đáp án đúng là: D
Các chất NH4Cl; CO có liên kết cho nhận.
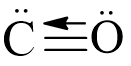
Carbon monoxide
Câu 27:
Đáp án đúng là: A
Các phát biểu (a) và (c) đúng.
Câu 28:
Đáp án đúng là: B
Liên kết hydrogen là một loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị riêng.
Vậy CH4 không thể tạo được liên kết hydrogen.
Phần II: Tự luận
Câu 29:
- Cấu hình electron K+: 1s22s22p63s23p6 Þ giống cấu hình electron của khí hiếm argon.
- Cấu hình electron Mg2+: 1s22s22p6 Þ giống cấu hình electron của khí hiếm neon.
- Cấu hình electron F–: 1s22s22p6 Þ giống cấu hình electron của khí hiếm neon.
- Cấu hình electron S2–: 1s22s22p63s23p6 Þ giống cấu hình electron của khí hiếm argon.
Câu 30:
- MgCl2: liên kết ion.
- AlCl3: liên kết cộng hóa trị phân cực.
- HBr: liên kết cộng hóa trị phân cực.
- O2, H2 liên kết cộng hóa trị không phân cực do được hình thành từ hai nguyên tử giống nhau.
- NH3: liên kết cộng hóa trị phân cực.
Câu 31:
Khi đi từ F2 đến I2, do khối lượng các phân tử tăng dần làm tương tác van der Waals giữa các phân tử halogen cũng tăng dần, nên fluorine và chlorine ở trạng thái khí, còn bromine ở trạng thái lỏng và iodine ở trạng thái rắn.
Đề thi học kì 1 Hóa học lớp 10 Chân trời sáng tạo có đáp án năm 2024 - 2025 - Đề 2
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1 - Chân trời sáng tạo
Năm học 2024 - 2025
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 2)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron và neutron.
B. proton và neutron.
C. neutron và electron.
D. electron, proton và neutron.
Câu 2: Nếu đường kính của nguyên tử khoảng 102 pm thì đường kính của hạt nhân khoảng
A. 102 pm.
B. 10-4 pm.
C. 10-2 pm.
D. 104 pm.
Câu 3: Số neutron (N) trong nguyên tử của một nguyên tố hoá học có thể tính được khi biết số khối (A), số hiệu nguyên tử (Z) theo công thức:
A. A = Z – N.
C. A = N – Z.
D. Z = N + A.
Câu 4: Nguyên tử Z có 7 neutron và 6 proton. Kí hiệu nguyên tử của Z là
A. .
B. .
C. .
D. .
Câu 5: Hình ảnh dưới đây là hình dạng của loại orbital nguyên tử nào?
A. Orbital s.
B. Orbital p.
C. Orbital d.
D. Orbital f.
Câu 6: Lớp M có bao nhiêu phân lớp?
A. 1.
B. 2.
C. 3.
D. 4.
Câu 7: Cho nguyên tử X có 2 lớp eletron, lớp thứ 2 có 6 electron. Số hiệu nguyên tử X là
A. 8.
B. 6.
C. 12.
D. 16.
Câu 8: Ở trạng thái cơ bản, nguyên tử phosphorus (P) có số electron độc thân là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 9: Nhóm nguyên tố là
A. tập hợp các nguyên tố mà nguyên tử có cùng cấu hình electron giống nhau được xếp ở cùng một cột.
B. tập hợp các nguyên tố mà nguyên tử có cấu hình electron gần giống nhau, do đó có tính chất hóa học giống nhau và được xếp thành một cột.
C. tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp cùng một cột.
D. tập hợp các nguyên tố mà nguyên tử có tính chất hóa học giống nhau và được xếp cùng một cột.
Câu 10: Nguyên tố nào sau đây thuộc nhóm A?
A. [Ne]3s23p3.
B. [Ar]3d14s2.
C. [Ar]3d74s2.
D. [Ar]3d54s2.
Câu 11: Trong các nguyên tố nhóm A, đại lượng nào sau đây không biến đổi tuần hoàn?
A. Bán kính nguyên tử.
B. Tính kim loại.
C. Độ âm điện.
D. Khối lượng nguyên tử.
Câu 12: Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, những yếu tố sẽ tăng dần là
A. bán kính nguyên tử và tính phi kim.
B. độ âm điện và tính phi kim.
C. bán kính nguyên tử và tính kim loại.
D. độ âm điện và tính kim loại.
Câu 13: Nguyên tố R có cấu hình electron: 1s22s22p4. Công thức hợp chất oxide ứng với hóa trị cao nhất của R là
A. RO3.
B. R2O3.
C. R2O7.
D. R2O5.
Câu 14: Dãy nào sau đây sắp xếp thứ tự tăng dần tính acid?
A. H3PO4 ; H2SO4 ; H3AsO4.
B. H2SO4 ; H3AsO4 ; H3PO4.
C. H3PO4; H3AsO4; H2SO4.
D. H3AsO4; H3PO4; H2SO4 .
Câu 15: Nguyên tố X ở chu kì 2, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s²2s²2p2.
B. 1s²2s2.
C. 1s²2s³.
D. 1s²2s²2p63s².
Câu 16: X và Y thuộc cùng một nhóm và ở hai chu kì liên tiếp. Tổng số đơn vị điện tích hạt nhân của X và Y là 18 (biết ZX < ZY). Hai nguyên tố X; Y là
A. Be (Z = 4) và Si (Z = 14).
B. B (Z = 5) và Al (Z = 13).
C. N (Z = 7) và Na (Z = 11).
D. C (Z = 6) và Mg (Z = 12).
Câu 17: Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt tới cấu hình electron bền vững theo quy tắc octet?
A. X (Z = 12).
B. Y (Z = 9).
C. Q (Z = 11).
D. T (Z = 10).
Câu 18: Công thức electron nào sau đây không đủ electron theo quy tắc octet?
Câu 19: Liên kết ion có bản chất là
A. sự dùng chung các electron.
B. lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
C. lực hút tĩnh điện giữa cation kim loại với các electron tự do.
D. lực hút giữa các phân tử.
Câu 20: Cặp nguyên tố nào sau đây có khả năng tạo thành liên kết ion trong hợp chất của chúng?
A. Nitrogen và oxygen.
B. Carbon và oxygen.
C. Sulfur và oxygen.
D. Calcium và oxygen.
Câu 21: Hợp chất nào sau đây có liên kết cộng hóa trị phân cực?
A. H2.
B. NH3.
C. CH4.
D. N2.
Câu 22: Dãy nào sau đây gồm các chất chỉ có liên kết cộng hóa trị?
A. CaCl2, NaCl, NO2.
B. SO2, CO2, K2O.
C. SO3, H2S, H2O.
D. MgCl2, Na2O, HCl.
Câu 23: Trong phân tử nitrogen (N2), mỗi nguyên tử nitrogen đã góp ba electron để tạo cặp electron chung. Nhờ đó, mỗi nguyên tử nitrogen đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Xe.
B. Ne.
C. Ar.
D. Kr.
Câu 24: Phát biểu nào sau đây không đúng?
A. Chỉ có các AO có hình dạng giống nhau mới xen phủ với nhau để tạo liên kết.
B. Khi hình thành liên kết cộng hoá trị giữa hai nguyên tử, luôn có một liên kết δ.
C. Liên kết δ bền vững hơn liên kết π.
D. Có hai kiểu xen phủ hình thành liên kết là xen phủ trục và xen phủ bên.
Câu 25: Công thức Lewis của H2O là
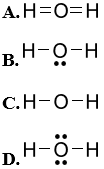
Câu 26: Phát biểu nào sau đây đúng với độ bền của một liên kết?
A. Khi nhiều liên kết được hình thành giữa hai nguyên tử, độ bền của liên kết sẽ giảm.
B. Độ bền của liên kết tăng khi độ dài của liên kết tăng.
C. Độ bền của liên kết tăng khi độ dài của liên kết giảm.
D. Độ bền của liên kết không phụ thuộc vào độ dài liên kết.
Câu 27: Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của
A. các nguyên tử trong phân tử.
B. các electron trong phân tử.
C. các proton trong hạt nhân.
D. các neutron và proton trong hạt nhân.
Câu 28: Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ với nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do
A. độ âm điện của chlorine nhỏ hơn nitrogen.
B. phân tử NH3 chứa nhiều nguyên tử hydrogen nhỏ hơn phân tử HCl.
C. tổng số nguyên tử trong phân tử NH3 nhiều hơn so với phân tử HCl.
D. kích thước nguyên tử chlorine lớn hơn nguyên tử nitrogen nên mật độ điện tích âm trên chlorine không đủ lớn để hình thành liên kết hydrogen.
Phần II: Tự luận (3 điểm)
Câu 29 (1 điểm): Anion X– có cấu hình electron nguyên tử ở phân lớp ngoài cùng là 3p6.
a) Viết cấu hình electron của nguyên tử X. Cho biết X là nguyên tố kim loại hay phi kim?
b) Giải thích sự hình thành liên kết giữa X với sodium.
Câu 30 (1 điểm): Viết ô orbital của lớp electron ngoài cùng cho nguyên tử H và Cl. Từ đó chỉ ra những AO nào có thể xen phủ tạo liên kết đơn trong các phân tử H2, Cl2 và HCl.
Câu 31 (1 điểm): Giải thích vì sao tetrachloromethane (CCl4) tuy là phân tử không cực nhưng có nhiệt độ sôi cao hơn trichloromethane (CHCl3) là phân tử có cực.
Đáp án đề thi Học kì 1 môn Hóa học 10 Chân trời sáng tạo - (Đề số 2)
Phần I: Trắc nghiệm
Câu 1:
Đáp án đúng là: B
Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là proton và neutron.
Câu 2:
Đáp án đúng là: C
Đường kính của nguyên tử lớn hơn đường kính của hạt nhân khoảng 10 000 lần.
Nếu đường kính của nguyên tử khoảng 102 pm thì đường kính của hạt nhân khoảng:
Câu 3:
Đáp án đúng là: B
Số khối kí hiệu là A, bằng tổng số hạt proton và neutron trong hạt nhân.
Vậy N = A – Z.
Câu 4:
Đáp án đúng là: B
Ta có:
- Số hiệu nguyên tử (Z) = số proton = 6.
- Số khối (A) = Z + N = 6 + 7 = 13.
Vậy kí hiệu nguyên tử là: .
Câu 5:
Đáp án đúng là: A
Orbital s có dạng hình cầu.
Câu 6:
Đáp án đúng là: C
Lớp M (n = 3), có 3 phân lớp là 3s, 3p và 3d.
Câu 7:
Đáp án đúng là: A
Cấu hình electron nguyên tử X: 1s22s22p4.
Vậy số hiệu nguyên tử X = số electron = 8.
Câu 8:
Đáp án đúng là: C
Cấu hình electron P theo ô orbital:

Ở trạng thái cơ bản P (Z = 15) có 3 electron độc thân.
Câu 9:
Đáp án đúng là: C
Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp cùng một cột.
Câu 10:
Đáp án đúng là: A
Nhóm A gồm các nguyên tố khối s, p.
Þ [Ne]3s23p3 thuộc khối p nên thuộc nhóm A.
Câu 11:
Đáp án đúng là: D
Trong các nguyên tố nhóm A, khối lượng nguyên tử không biến đổi tuần hoàn.
Câu 12:
Đáp án đúng là: C
Trong cùng một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần, bán kính nguyên tử tăng dần, độ âm điện giảm dần.
Câu 13:
Đáp án đúng là: A
R thuộc nhóm VIA, hóa trị cao nhất trong hợp chất là VI.
Công thức hợp chất oxide ứng với hóa trị cao nhất của R là RO3.
Câu 14:
Đáp án đúng là: D
|
|
VA |
VIA |
|
Chu kì 3 |
H3PO4 |
H2SO4 |
|
Chu kì 4 |
H3AsO4 |
|
Theo quy luật biến đổi ta có tính acid tăng dần theo dãy: H3AsO4; H3PO4; H2SO4 .
Câu 15:
Đáp án đúng là: B
X ở chu kì 2 nên có 2 lớp electron.
X ở nhóm IIA nên có 2 electron ở lớp ngoài cùng.
Cấu hình electron của X là: 1s²2s2.
Câu 16:
Đáp án đúng là: B
Theo bài ra ta có hệ phương trình:
Hai nguyên tố X; Y là B (Z = 5) và Al (Z = 13).
Câu 17:
Đáp án đúng là: A
X (Z =12): [Ne]3s2
Nguyên tử X có 2 electron ở lớp ngoài cùng, có xu hướng nhường 2 electron để đạt được cấu hình bền vững giống khí hiếm gần nhất.
Câu 18:
Đáp án đúng là: B
Trong công thức 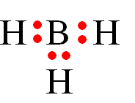 , nguyên tử B có 6 electron ở lớp ngoài cùng, chưa đạt octet.
, nguyên tử B có 6 electron ở lớp ngoài cùng, chưa đạt octet.
Câu 19:
Đáp án đúng là: B
Liên kết ion có bản chất là lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
Câu 20:
Đáp án đúng là: D
Liên kết được tạo thành giữa kim loại điển hình và phi kim điển hình là hợp chất ion.
⇒ Cặp nguyên tố calcium là oxygen có khả năng tạo thành liên kết ion trong hợp chất của chúng.
Câu 21:
Đáp án đúng là: B
NH3: Hợp chất có liên kết cộng hóa trị phân cực.
H2, CH4, N2: Hợp chất có liên kết cộng hóa trị không phân cực.
Câu 22:
Đáp án đúng là: C
Loại A vì CaCl2, NaCl là hợp chất ion.
Loại B vì K2O là hợp chất ion.
Loại D vì MgCl2, Na2O là hợp chất ion.
Câu 23:
Đáp án đúng là: B
N (Z = 7): 1s22s22p3.
N có 5 electron ở lớp ngoài cùng, có xu hướng nhận thêm 3 electron để đạt cấu hình electron bền vững giống với khí hiếm Ne.
Câu 24:
Đáp án đúng là: A
Khi các nguyên tử liên kết với nhau, các AO phải được sắp xếp ở vị trí phù hợp.
Chẳng hạn, khi hình thành phân tử hai nguyên tử, vị trí của các AO như sau:
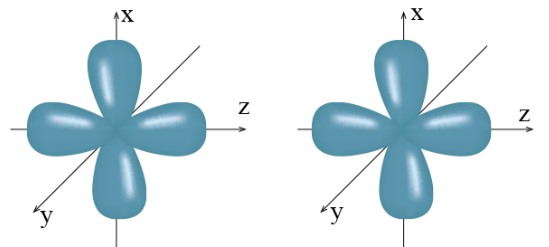
Khi đó, hai AO pZ nằm dọc trên cùng một trục nên chỉ có thể xen phủ trục với nhau, trong khi hai AO px (cũng như hai AO py) là song song với nhau nên chỉ có thể xen phủ bên với nhau.
Câu 25:
Đáp án đúng là: D
Công thức Lewis của H2O là:
![]()
Câu 26:
Đáp án đúng là: C
Độ bền của liên kết tăng khi độ dài của liên kết giảm.
Câu 27:
Đáp án đúng là: B
Tương tác van der Waals xuất hiện là do sự hình thành các lưỡng cực tạm thời cũng như các lưỡng cực cảm ứng. Các lưỡng cực tạm thời xuất hiện là do sự chuyển động của các electron trong phân tử.
Câu 28:
Đáp án đúng là: D
Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ với nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do kích thước nguyên tử chlorine lớn hơn nguyên tử nitrogen nên mật độ điện tích âm trên chlorine không đủ lớn để hình thành liên kết hydrogen.
Phần II: Tự luận
Câu 29:
a)
Cấu hình electron của ion X-: 1s22s22p63s23p6.
X + 1e → X-
Vậy cấu hình electron của X là: 1s22s22p63s23p5.
X là phi kim do có 7 electron ở lớp ngoài cùng.
b)
Giải thích sự hình thành liên kết giữa X với sodium:
Sodium có 1 electron, có xu hướng nhường đi 1 electron:
Na → Na+ + 1e
X có 7 electron ở lớp ngoài cùng, có xu hướng nhận 1 electron:
X + 1e → X-
Các ion sinh ra mang điện tích trái dấu, hút nhau tạo thành hợp chất ion:
Na+ + X- → NaX.
Câu 30:
- Cấu hình electron nguyên tử H (Z = 1): 1s1.
Ô orbital của lớp electron ngoài cùng:

- Cấu hình electron nguyên tử Cl (Z = 17): 1s22s22p63s23p5.
Ô orbital của lớp electron ngoài cùng:
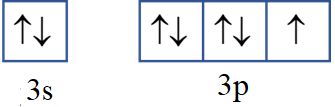
Nhận xét:
- 1 AO s xen phủ với 1 AO s tạo thành phân tử H2.
- 1 AO p xen phủ với 1 AO p tạo thành phân tử Cl2.
- 1 AO s (H) xen phủ với 1 AO p (Cl) tạo thành phân tử HCl.
Câu 31:
Tetrachloromethane (CCl4) tuy là phân tử không cực nhưng có nhiệt độ sôi cao hơn trichloromethane (CHCl3) là phân tử có cực.
Điều này do phân tử CCl4 có kích thước lớn hơn CHCl3 nên có số electron cũng nhiều hơn CHCl3, do đó tương tác van der Waals giữa các phân tử CCl4 mạnh hơn so với CHCl3 làm cho nhiệt độ sôi của CCl4 cao hơn CHCl3.
Đề thi học kì 1 Hóa học lớp 10 Chân trời sáng tạo có đáp án năm 2024 - 2025 - Đề 3
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1 - Chân trời sáng tạo
Năm học 2024 - 2025
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 3)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Phương pháp nghiên cứu lí thuyết là
A. nghiên cứu những vấn đề dựa trên kết quả thí nghiệm, khảo sát, thu thập số liệu, phân tích, định lượng…
B. giải quyết các vấn đề hóa học được ứng dụng trong các lĩnh vực khác nhau.
C. nghiên cứu thành phần, cấu trúc, tính chất và sự biến đổi của chất.
D. sử dụng những định luật, nguyên lí, quy tắc, cơ chế, mô hình … để tiếp tục làm rõ những vấn đề của lí thuyết hóa học.
Câu 2: Nguyên tử aluminium (nhôm) có điện tích hạt nhân là +13. Số hạt mang điện có trong nguyên tử này là
A. 13.
B. 26.
C. 39.
D. 38.
Câu 3: Nguyên tử đồng (copper) có 29 proton và 34 neutron. Số khối của nguyên tử đồng là
A. 63.
B. 64.
C. 58.
Câu 4: Tỉ lệ phần trăm số nguyên tử các đồng vị tự nhiên của chlorine (Cl) được xác định theo phổ khối lượng sau:
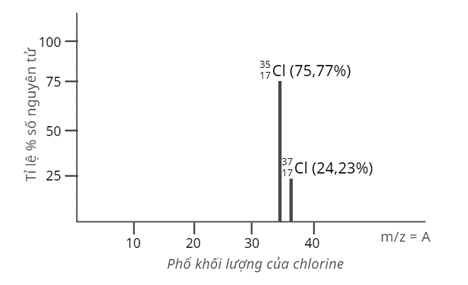
Nguyên tử khối trung bình của Cl là
A. 34,45.
B. 35,48.
C. 36,48.
D. 36,50.
Câu 5: Sự phân bố electron trong một orbital dựa vào nguyên lí hay quy tắc nào sau đây?
B. Quy tắc Hund.
C. Nguyên lí Pauli.
Câu 6: Phát biểu nào sau đây đúng?
A. Electron ở orbital 3p có mức năng lượng thấp hơn electron ở orbital 3s.
B. Các electron trong cùng một lớp có mức năng lượng bằng nhau.
C. Những electron ở lớp K có mức năng lượng thấp nhất.
D. Những electron ở gần hạt nhân có mức năng lượng cao nhất.
Câu 7: Phân lớp 3d có số electron tối đa là
A. 6.
B. 18.
C. 14.
Câu 8: Cấu hình electron của nguyên tử Al (Z = 13) là
A. 1s22s22p63s23p2.
B. 1s22s22p63s1.
C. 1s22s22p63s23p1.
Câu 9: Nguyên tố X (Z = 19) thuộc chu kì nào trong bảng tuần hoàn?
A. Chu kì 1.
B. Chu kì 2.
C. Chu kì 3.
D. Chu kì 4.
Câu 10: Bảng tuần hoàn hiện nay gồm có bao nhiêu nguyên tố hóa học?
A. 119.
B. 118.
C. 117.
D. 115.
Câu 11: Cho các nguyên tử C (Z = 6); N (Z = 7); Al (Z = 13); P (Z = 15). Nguyên tử có bán kính lớn nhất là
A. N.
B. P.
C. Al.
Câu 12: Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử,
A. bán kính nguyên tử tăng, độ âm điện giảm.
B. bán kính nguyên tử giảm, độ âm điện tăng.
C. bán kính nguyên tử và độ âm điện đều giảm.
D. bán kính nguyên tử và độ âm điện đều tăng.
Câu 13: Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, nguyên tố nào sau đây có tính phi kim mạnh nhất?
A. Na.
B. Cs.
C. F.
Câu 14: Cấu hình electron nguyên tử của 3 nguyên tố X, Y, T lần lượt là: 1s22s22p63s1, 1s22s22p63s23p64s1, 1s22s22p63s23p1. Thứ tự tăng dần tính kim loại là
A. T < X < Y.
B. T < Y < Z.
C. Y < T < X.
D. Y < X < T.
Câu 15: Nguyên tử của nguyên tố R có cấu hình electron: 1s22s22p3. Công thức hợp chất oxide ứng với hóa trị cao nhất của R là
A. RO2.
B. R2O5.
C. RO3.
D. R2O3.
Câu 16: Nguyên tố X ở ô thứ 17 của bảng tuần hoàn các nguyên tố hóa học. Có các phát biểu sau:
(1) X có độ âm điện lớn nhất và là một phi kim mạnh nhất.
(2) X có thể tạo thành ion bền có dạng X-.
(3) Oxide cao nhất của X có công thức X2O5 và là acidic oxide.
(4) Hydroxide của X có công thức HXO3 và là acid mạnh.
Trong các phát biểu trên, số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 0.
Câu 17: Nguyên tử nào sau đây có lớp electron ngoài cùng bền vững?
A. K (Z = 19).
B. Cl (Z = 17).
C. He (Z = 2).
D. Al (Z = 13).
Câu 18: Để đạt được quy tắc octet, nguyên tử nitrogen (Z = 7) phải nhận thêm
A. 2 electron.
B. 1 electron.
C. 3 electron.
D. 4 electron.
Câu 19: Cho các ion sau: K+, O2-; Mg2+; N3-. Số ion có cấu hình electron của khí hiếm Ne là
A. 4.
B. 3.
C. 2.
D. 1.
Câu 20: Phân tử K2O được hình thành do
A. sự kết hợp giữa 2 nguyên tử K và nguyên tử O.
B. sự kết hợp giữa 2 ion K+ và ion O2-.
C. sự kết hợp giữa 1 ion K+ và ion O2-.
D. sự kết hợp giữa 1 ion K2+ và ion O-.
Câu 21: Liên kết hóa học trong phân tử Br2 thuộc loại liên kết nào?
A. Liên kết ion.
B. Liên kết hydrogen.
C. Liên kết cộng hóa trị không cực.
D. Liên kết cộng hóa trị có cực.
Câu 22: Chất nào đây trong phân tử có chứa liên kết ba?
A. H2.
B. O2.
C. SO2.
D. N2.
Câu 23: Cho dãy các chất: N2, H2, NH3, NaCl, HCl, H2O. Số chất trong dãy mà phân tử chỉ chứa liên kết cộng hóa trị phân cực là
A. 2.
B. 3.
C. 4.
D. 5.
Câu 24: Chất nào sau đây trong phân tử có chứa liên kết cho - nhận?
A. NH3.
B. N2.
C. O2.
D. CO.
Câu 25: Cho độ âm điện của các nguyên tử sau:
|
Nguyên tử |
C |
H |
Cl |
N |
Mg |
O |
|
Độ âm điện |
2,55 |
2,2 |
3,16 |
3,04 |
1,31 |
3,44 |
Dựa vào hiệu độ âm điện, chất có liên kết ion là
A. CH4.
B. HCl.
C. NH3.
D. MgO.
Câu 26: Cho các phân tử sau: Cl2, O2, HCl, N2. Số phân tử có chứa liên kết bội là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 27: Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử?
A. CO2.
B. CH4.
C. NH3.
D. H2S.
Câu 28: Khí hiếm nào dưới đây có nhiệt độ sôi cao nhất?
A. He.
B. Ne.
C. Ar.
D. Kr.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Sodium fluoride (NaF) là thành phần hoạt chất phổ biến nhất trong kem đánh răng để ngăn ngừa sâu răng, hình thành men răng. Giải thích sự hình thành liên kết ion trong phân tử sodium fluoride.
Câu 2 (1 điểm): Vì sao phân tử NH3 có khả năng kết hợp với cation H+? Viết công thức Lewis của ion này.
Câu 3 (1 điểm): Hãy giải thích vì sao ở điều kiện thưởng Br2 ở trạng thái lỏng, còn Cl2 ở trạng thái khí?
Đề thi học kì 1 Hóa học lớp 10 Chân trời sáng tạo có đáp án năm 2024 - 2025 - Đề 4
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1 - Chân trời sáng tạo
Năm học 2024 - 2025
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 4)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Trong các hiện tượng sau, hiện tượng nào không phải là hiện tượng hóa học?
A. Đường cháy thành than.
B. Cơm bị ôi thiu.
C. Sữa chua lên men.
D. Nước lỏng hóa rắn ở 0oC.
Câu 2: Trong nguyên tử, hạt không mang điện tích là
A. hạt proton.
B. hạt neutron.
C. hạt nhân.
D. hạt electron.
Câu 3: Có 3 nguyên tử: . Những nguyên tử nào là đồng vị của một nguyên tố hóa học?
A. X, Y.
B. Y, Z.
C. X, Z.
D. X, Y, Z.
Câu 4: Nguyên tố hóa học là những nguyên tử có cùng
A. số khối.
B. số proton.
C. số neutron.
D. số proton và số neutron.
Câu 5: Orbital nguyên tử là
A. đám mây chứa electron có dạng hình cầu.
B. đám mây chứa electron có dạng hình số 8 nổi.
C. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron khoảng 90%.
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước và năng lượng xác định.
Câu 6: Hình ảnh sau minh họa cho orbital nào?
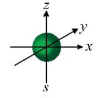
A. Orbital s.
B. Orbital p.
C. Orbital d.
D. Orbital f.
Câu 7: Ở trạng thái cơ bản, nguyên tử nào sau đây có electron độc thân?
A. He (Z = 2).
B. Mg (Z = 12).
C. K (Z = 19).
D. Ca (Z = 20).
Câu 8: Ở trạng thái cơ bản, cấu hình electron của nguyên tử phosphorus (Z = 15) là
A. 1s22s22p53s23p4.
B. 1s22s22p63s23p3.
C. 1s22s22p63s2.
D. 1s22s22p43s23p3.
Câu 9: X là nguyên tố nhóm IIIA. Công thức oxide ứng với hóa trị cao nhất của X là
A. XO.
B. XO2.
C. X2O.
D. X2O3.
Câu 10: Nguyên tử nguyên tố nào sau đây có bán kính nhỏ nhất?
A. F.
B. Cl.
C. Br.
D. I.
Câu 11: Nguyên tố Y thuộc chu kì 4, nhóm IA của bảng tuần hoàn. Phát biểu nào sau đây về Y là đúng?
A. Y có độ âm điện lớn nhất và bán kính nguyên tử lớn nhất trong chu kì 4.
B. Y có độ âm điện lớn nhất và bán kính nguyên tử nhỏ nhất trong chu kì 4.
C. Y có độ âm điện nhỏ nhất và bán kính nguyên tử lớn nhất trong chu kì 4.
D. Y có độ âm điện nhỏ nhất và bán kính nguyên tử nhỏ nhất trong chu kì 4.
Câu 12: Các nguyên tố trong bảng tuần hoàn được sắp xếp theo chiều tăng dần của
A. khối lượng nguyên tử.
B. bán kính nguyên tử.
C. số hiệu nguyên tử.
D. độ âm điện của nguyên tử.
Câu 13: Nguyên tử của nguyên tố X có 10 proton, 10 neutron và 10 electron. Vị trí của nguyên tố X trong bảng tuần hoàn là
A. chu kì 2 và nhóm VA.
B. chu kì 2 và nhóm VIIIA.
C. chu kì 3 và nhóm VIIA.
D. chu kì 3 và nhóm VA.
Câu 14: Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của X là
A. 1s22s22p63s23p3.
B. 1s22s22p63s23p5.
C. 1s22s22p63s23p2.
D. 1s22s22p53s23p4.
Câu 15: Số hiệu nguyên tử Z của các nguyên tố X, A, M, Q lần lượt là 6, 7, 20, 19. Nhận xét nào sau đây là đúng?
A. Cả 4 nguyên tố trên thuộc 1 chu kì.
B. A, M thuộc chu kì 3.
C. M, Q thuộc chu kì 4.
D. Q thuộc chu kì 3.
Câu 16: Anion X2- có cấu hình electron [Ne]3s23p6. Nguyên tố X có tính chất nào sau đây?
A. Tính kim loại.
B. Tính phi kim.
C. Tính trơ của khí hiếm.
D. Tính lưỡng tính.
Câu 17: Để đạt quy tắc octet, nguyên tử của nguyên tố sodium (Z = 11) phải
A. nhường đi 2 electron.
B. nhường đi 1 electron.
C. nhận thêm 2 electron.
D. nhận thêm 1 electron.
Câu 18: Nguyên tử trong phân tử nào sau đây ngoại lệ với quy tắc octet?
A. H2O.
B. NH3.
C. HCl.
D. BF3.
Câu 19: Cho mô hình tinh thể NaCl như sau:
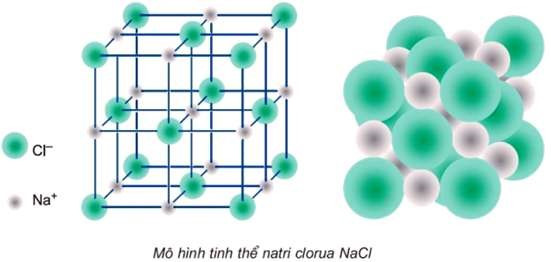
Số ion chloride (Cl–) bao quanh gần nhất với ion sodium (Na+) là
A. 3.
B. 5.
C. 6.
D. 4.
Câu 20: Cho giá trị độ âm điện của nguyên tử các nguyên tố: F (3,98); O (3,44); C (2,55); H (2,20); Na (0,93). Hợp chất nào sau đây là hợp chất ion?
A. NaF.
B. CO2.
C. CH4.
D. H2O.
Câu 21: Trong phân tử chlorine (Cl2), mỗi nguyên tử chlorine đã góp 1 electron để tạo thành cặp electron chung. Nhờ đó, mỗi nguyên tử chlorine đã đạt cấu hình electron bền vững của khí hiếm nào dưới đây?
A. Ne.
B. Ar.
C. Kr.
D. Xe.
Câu 22: Liên kết cộng hóa trị phân cực thường là liên kết giữa
A. hai phi kim khác nhau.
B. kim loại điển hình với phi kim yếu.
C. hai phi kim giống nhau.
D. hai kim loại với nhau.
Câu 23: Điều nào sau đây sai khi nói về tính chất của hợp chất cộng hoá trị?
A. Các hợp chất cộng hoá trị có nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn các hợp chất ion.
B. Các hợp chất cộng hoá trị có thể ở thể rắn, lỏng hoặc khí trong điều kiện thường.
C. Các hợp chất cộng hoá trị đều dẫn điện tốt.
D. Các hợp chất cộng hoá trị không phân cực tan được trong dung môi không phân cực.
Câu 24: Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital s-s?
A. H2.
B. Cl2.
C. NH3.
D. HCl.
Câu 25: Số lượng electron tham gia hình thành liên kết đơn, đôi, ba lần lượt là
A. 1, 2 và 3.
B. 2, 4 và 6.
C. 1, 3 và 5.
D. 2, 3 và 4.
Câu 26: Các chất mà phân tử không phân cực là
A. HBr, CO2, CH4.
B. Cl2, CO2, C2H2.
C. NH3, Br2, C2H4.
D. HCl, C2H2, Br2.
Câu 27: Tương tác van der Waals được hình thành do
A. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử.
B. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các phân tử.
C. tương tác tĩnh điện lưỡng cực – lưỡng cực giữa các nguyên tử hay phân tử.
D. lực hút tĩnh điện giữa các phân tử phân cực.
Câu 28: Cho các chất sau: CH4, H2O, NH3, PF3, CH3OH. Số chất tạo được liên kết hydrogen là
A. 2.
B. 3.
C. 4.
D. 5.
Phần II: Tự luận (3 điểm)
Câu 29 (1 điểm): Trình bày sự tạo thành liên kết ion trong phân tử sodium fluoride (NaF). Biết Na (Z = 11); F (Z = 9).
Câu 30 (1 điểm): Giải thích sự tạo thành liên kết trong phân tử ammonia. Viết công thức electron, công thức cấu tạo và công thức Lewis của hợp chất này. Cho N (Z = 7); H (Z = 1).
Câu 31 (1 điểm): Lithium fluoride (LiF) và sodium chloride (NaCl) đều là các hợp chất ion. Dự đoán nhiệt độ sôi và nhiệt độ nóng chảy của chất nào cao hơn? Giải thích.
Đề thi học kì 1 Hóa học lớp 10 Chân trời sáng tạo có đáp án năm 2024 - 2025 - Đề 5
Phòng Giáo dục và Đào tạo .....
Đề thi Học kì 1 - Chân trời sáng tạo
Năm học 2024 - 2025
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 5)
Câu 1 : Công thức cấu tạo của phân tử cafein, một chất gây đắng tìm thấy nhiều trong cafe và trà được biểu diễn ở hình dưới
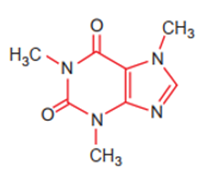
Nguyên tố N tạo nên cafein, có vị trí trong bảng tuần hoàn là
ô số 6, chu kì 3, nhóm IIA.
ô số 4, chu kì 2, nhóm VIA
ô số 5, chu kì 4, nhóm IVA.
ô số 7, chu kì 2, nhóm VA.
Câu 2 : Đây là hình ảnh của helium siêu lỏng, nhìn thì có vẻ bình thường nhưng vật chất siêu lỏng này không có ma sát bò trên thành cốc và tự chảy ra ngoài.

Vị trí của helium trong bảng tuần hoàn hóa học thuộc
nhóm VA, chu kỳ 4.
nhóm IVA, chu kỳ 3.
nhóm VIIIA, chu kỳ 1.
nhóm VIIA, chu kỳ 2.
Câu 3 : Các nguyên tố theo hình dưới, số electron ở lớp ngoài cùng là

1 electron.
3 electron.
4 electron.
2 electron.
Câu 4 : Liên kết cộng hóa trị là liên kết hóa học được hình thành giữa hai nguyên tử bằng
một hay nhiều cặp electron dùng chung.
sự cho-nhận electron.
một electron chung.
một cặp electron góp chung.
Câu 5 : Cho các chất N2, H2, NH3, NaCl, HCl, H2O, số chất mà phân tử chỉ chứa liên kết cộng hóa trị không phân cực là
3
2
5
4
Câu 6 : Liên kết hydrogen là loại liên kết hoá học được hình thành giữa các nguyên tử nào sau đây?
Phi kim và hydrogen trong hai phân tử khác nhau.
F,O,N,… có độ âm điện lớn, đồng thời có cặp electron hoá trị chưa liên kết và nguyên tử hydrogen linh động.
Phi kim có độ âm điện lớn và nguyên tử hydrogen.
Phi kim và hydrogen trong cùng một phân tử.
Câu 7 : Anion X- và cation Y2+ đều có cấu hình electron lớp ngoài cùng là 3s23p6. Vị trí của các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học là:
X có số thứ tự 17, chu kỳ 4, nhóm VIIA ; Y có số thứ tự 20, chu kỳ 4, nhóm IIA
X có số thứ tự 17, chu kỳ 3, nhóm VIIA ; Y có số thứ tự 20, chu kỳ 4, nhóm IIA
X có số thứ tự 18, chu kỳ 3, nhóm VIIA ; Y có số thứ tự 20, chu kỳ 3, nhóm IIA
X có số thứ tự 18, chu kỳ 3, nhóm VIA ; Y có số thứ tự 20, chu kỳ 4, nhóm IIA
Câu 8 : Hai nguyên tố X và Y cùng một chu kì trong bảng tuần hoàn các nguyên tố hóa học, X thuộc nhóm IIA, Y thuộc nhóm IIIA (ZX + ZY = 51). Phát biểu nào sau đây đúng?
Kim loại X không khử được ion Cu2+ trong dung dịch.
Hợp chất với oxygen của X có dạng X2O7.
Trong nguyên tử nguyên tố X có 25 proton.
Ở nhiệt độ thường X không khử được H2O.
Câu 9 : Cation R3+ có cấu hình electron lớp ngoài cùng là 2p6. Công thức oxide ứng với hóa trị cao nhất, hydroxide tương ứng của R và tính acid – base của chúng là
R2O3, R(OH)3 (đều lưỡng tính)
RO3 (acidic oxide), H2RO4 (acid)
RO2 (acidic oxide), H2RO3 (acid)
RO (basic oxide), R(OH)2 (base).
Câu 10 : Nguyên tố phổ biến nhất trong vỏ trái đất là
iron.
silicon.
aluminium.
oxygen.
Câu 11 : Liên kết ion được tạo thành giữa hai nguyên tử bằng
một hay nhiều cặp electron dùng chung.
một hay nhiều cặp electron dùng chung nhưng chỉ do một nguyên tử đóng góp.
lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
một hay nhiều cặp electron dùng chung và cặp electron dùng chung bị lệch về phía nguyên tử có độ âm điện lớn hơn.
Câu 12 : Nguyên tố X thuộc nhóm VIA của bảng tuần hoàn các nguyên tố hóa học. Công thức hợp chất khí với H của X là
H4X.
H3X.
H2X.
HX.
Câu 13 : Hai ion X+ và Y- đều có cấu hình electron của khí hiếm Ar (Z=18). Cho các phát biểu sau:
(1) Số hạt mang điện của X nhiều hơn số hạt mang điên của Y là 4.
(2) Bán kính ion Y- lớn hơn bán kính ion X+.
(3) X ở chu kì 3, còn Y ở chu kì 4 trong bảng hệ thống tuần hoàn.
(4) Độ âm điện của X nhỏ hơn độ âm điện của Y.
(5) X thuộc loại nguyên tố p.
Số phát biểu đúng là
1
2
3
4
Câu 14 : Nguyên lí hay quy tắc nào bị vi phạm trong cấu hình theo ô orbital được cho dưới đây?
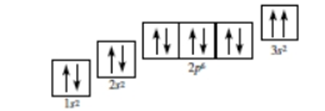
Quy tắc của Hund.
Không vi phạm nguyên lí, quy tắc nào.
Nguyên lí Pauli.
Quy tắc Klechkovski.
Câu 15 : Cho công thức hợp chất A như sau: HC≡C – CH2 = CH2. Số liên kết 𝛔 trong hợp chất A là
5
4
6
7
Câu 16 : Tỉ lệ phần trăm số nguyên tử các đồng vị của Neon (Ne) được xác định theo phổ khối lượng sau:
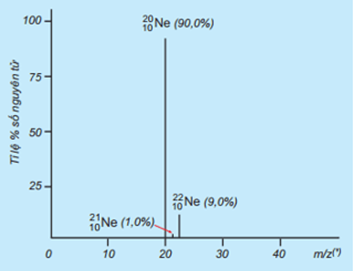
Giá trị nguyên tử khối trung bình của Ne là
19,19.
20,20.
19,20.
20,19.
Câu 17 : Nguyên tố Chlorine (Z = 17) thường được sử dụng để khử trùng nước máy trong sinh hoạt. Cho biết chlorine là phi kim tại vì
lớp ngoài cùng có 2 electron.
lớp ngoài cùng có 7 electron.
lớp ngoài cùng có 5 electron.
lớp ngoài cùng có 6 electron.
Câu 18 : Dãy các chất nào dưới đây mà tất cả các phân tử đều có liên kết cộng hoá trị không phân cực?
N2, HI, Cl2, CH4.
N2, Cl2, H2, HCl.
Cl2, O2, N2, F2.
N2, CO2, Cl2, H2.
Câu 1 : X,Y là hai nguyên tố thuộc nhóm A trong cùng một chu kì của bảng tuần hoàn. Oxide cao nhất của X,Y có dạng XO, YO3. Cho các phát biểu sau :
(a) X,Y thuộc 2 nhóm A kế tiếp nhau.
(b) X là kim loại,Y là phi kim.
(c) XO là basic oxide còn YO3 là acidic oxide
(d) Hydroxide cao nhất của X có dạng X(OH)2 và có tính base.
Câu 2 : Electron của ion X- là 1s22s22p63s23p63d104s24p6. Cho các phát biểu sau:
(a) X ở ô 36, chu kỳ 4, VIIIA.
(b) Ion X- có 36 proton.
(c) X có tính phi kim.
(d) Bán kính ion X- nhỏ hơn bán kính của X.
Câu 3 : Nguyên tố X tích luỹ trong các tế bào thực vật nên rau và trái cây tươi là nguồn cung cấp tốt nguyên tố X cho cơ thể. Các nghiên cứu chỉ ra khẩu phần ăn chứa nhiều X có thể giảm nguy cơ cao huyết áp và đột quỵ. Nguyên tố Z được dùng chế tạo dược phẩm, phẩm nhuộm và chất nhạy với ánh sáng. Nguyên tử X chỉ có 7 electron trên phân lớp s; còn nguyên tử Z chỉ có 17 electron trên phân lớp p
(a) X là potassium
(b) Hợp chất tạo bởi X và Z chứa liên kết ion.
(c) Hợp chất tạo bởi X và Z có tính dẫn điện khi bị nóng chảy hoặc hòa tan trong nước
(d) Z thuộc nhóm VIA, chu kì 4.
Câu 4 : Soudime ( 11Na) và Magienime (12Mg) thuộc chu kì 3 trong bảng tuần hoàn các nguyên tố hóa học.
a. Na và Mg đều có 3 electron hóa trị.
b. Dựa vào mức độ phản ứng của Na và Mg với nước ở điều kiện thường, có thể so sánh được độ hoạt động hóa học giữa Na với Mg.
c. Tính base của sodium hydroxide yếu hơn tính base của magnesium hydroxide.
d. Khi phản ứng với Cl2, Na và Mg đều tạo ra hợp chất ion.
Câu 1 : Cho 6 nguyên tố có số hiệu nguyên tử lần lượt là 9, 11, 17, 18, 19 và 20. Trong số các nguyên tố trên có bao nhiêu nguyên tố phi kim?
Câu 2 : Có bao nhiêu hợp chất tạo được liên kết Hydrogen trong dãy các chất sau: NH3, HF, HCl, PH3, C2H5OH?
Câu 3 : Một nguyên tố tạo hợp chất khí với hydrogen có công thức RH3, được sử dụng để trung hoà các thành phần acid của dầu thô, bảo vệ thiết bị không bị ăn mòn trong ngành công nghiệp dầu khí. Nguyên tố này chiếm 25,93% về khối lượng trong oxide cao nhất. % khối lượng của nguyên tố R trong hợp chất khí với hydrogen là bao nhiêu ?
Câu 4 : Giả thiết trong tinh thể các nguyên tử Fe là những hình cầu chiếm 75% thể tích, phần còn lại là các khe rỗng giữa các quả cầu, cho nguyên tử khối Fe là 55,85 ở 20oC có khối lượng riêng của tinh thể Fe là 7,87g/cm3. Bán kính nguyên tử Fe là?
ĐÁP ÁN
| Câu 1-D | Câu 2-D | Câu 3-C | Câu 4-A | Câu 5-B | Câu 6-B |
| Câu 7-B | Câu 8-A | Câu 9-A | Câu 10-D | Câu 11-C | Câu 12-C |
| Câu 13-C | Câu 14-C | Câu 15-C | Câu 16-D | Câu 17-B | Câu 18-D |
Vì oxide của X có dạng XO nên X ở nhóm IIA.
Oxide của Y có dạng YO3 nên Y ở nhóm VIA.
(a) sai, X,Y thuộc nhóm A không kế tiếp nhau
(b) đúng
(c) đúng
(d) đúng.
Câu 2 :
Ion X- có 36 electron nên X có 35 electron. Vậy X ô số 35 (bromine).
(a) sai, X ở ô số 35.
(b) sai, ion X- có 35 proton.
(c) đúng
(d) sai vì Khi nguyên tử biến thành anion, electron nhận thêm vào làm tăng tương tác đẩy electron – electron làm cho kích thước ion tăng thêm.
Câu 3 :
Cấu hình X là: 1s2 2s22p6 3s23p6 4s1 nên X có 19 electron.
Cấu hình X: 1s2 2s22p6 3s23p63d10 4s2 4p5 nên Z có 35 electron.
(a) đúng
(b) đúng
(c) đúng
(d) sai, X tuộc nhóm VIIA.
Câu 4 :
a. sai, Na có 1 electron hóa trị, Mg có 2 electron hóa trị.
b. đúng
c. sai, tính base của sodium hydroxide mạnh hơn tính base của magnesium hydroxide.
d. đúng
Câu 1 :
Các nguyên tử có số hiệu lần lượt là: 9, 17 thuộc nguyên tố phi kim
Đáp án 2
Câu 2 :
NH3, HF, HCl, C2H5OH có liên kết hydrogen.
Đáp án 4
Câu 3 :
Vì nguyên tố tạo hợp chất khí với hydrogen có công thứ RH3 nên oxide của R có công thức là R2O5.
Ta có : %R =
%N trong NH3 là :
Câu 4 :
Xét 1 mol tinh thể Fe chứa 6,022.1023 nguyên tử Fe xếp khít nhau và các khe rỗng.
(Ghi chú: Tinh thể viết tắt là tt).
→ mtt = 55,85 gam
→ Vtt = mtt : Dtt = 55,85 : 7,87 = 7,1 cm3
→ Vphần đặc = 7,1.75% = 5,325 cm3
→ V1 nguyên tử = 5,325 : 6,022.1023 = 8,84.10-24 (cm3)
Mà nguyên tử có hình cầu nên:
Vnguyên tử = 4/3.π.r3
→ 8,84.10-24 = 4/3.3,14.r3
→ r = 1,283.10-8 cm.