Tailieumoi.vn xin giới thiệu Trắc nghiệm Hóa học lớp 10 Bài 5: Lớp, phân lớp và cấu hình electron sách Cánh diều. Bài viết gồm 20 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm Hóa học 10. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 5: Lớp, phân lớp và cấu hình electron. Mời các bạn đón xem:
Trắc nghiệm Hóa học 10 Bài 5: Lớp, phân lớp và cấu hình electron
Phần 1: Trắc nghiệm Lớp, phân lớp và cấu hình electron
Câu 1. Số electron tối đa trên mỗi phân lớp ns; np; nd; nf lần lượt là
A. 1; 4; 9; 16
B. 2; 8; 18; 32
C. 1; 3; 5; 7
D. 2; 6; 10; 14
Đáp án: D
Giải thích:
Mỗi AO chứa tối đa 2 electron
- Phân lớp ns có 1 AO nên có tối đa 2 electron
- Phân lớp np có 3 AO nên có tối đa 6 electron
- Phân lớp nd có 5 AO nên có tối đa 10 electron
- Phân lớp ns có 7 AO nên có tối đa 14 electron
Câu 2. Số phân lớp ở lớp eletron thứ n là
A. 2n2
B. n2
C. n
D. 2n
Đáp án: C
Giải thích: Lớp electron thứ n có n phân lớp và được kí hiệu lần lượt là ns, np, nd, nf, …
Câu 3. Khẳng định nào sau đây là sai?
Kí hiệu 2p5 cho biết
A. phân lớp 2p có 5 electron;
B. phân lớp này ở lớp L;
C. phân lớp này có 1 electron độc thân;
D. phân lớp 2p đã bão hòa.
Đáp án: D
Giải thích:
- Chỉ số phía trên bên phải kí hiệu phân lớp biểu diễn số electron trong phân lớp. Nên kí hiệu 2p5 cho biết phân lớp 2p có 5 electron. → Khẳng định A đúng
- Phân lớp 2p ở lớp thứ 2 có tên là lớp L. → Khẳng định B đúng
- Phân lớp 2p có 5 electron phân bố vào 3 AO, mỗi AO chứa tối đa 2 electron nên sẽ có 1 AO chỉ có 1 electron, electron đó gọi là electron độc thân. Do đó phân lớp này có 1 electron độc thân. → Khẳng định C đúng
- Phân lớp này chưa chứa đủ số electron tối đa (6 electron) nên chưa bão hòa. → Khẳng định D sai.
Câu 4. Lớp N có các phân lớp được kí hiệu lần lượt là
A. 3s, 3p, 3d;
B. 4s, 4p, 4d;
C. 4s, 4p, 4d, 4f;
D. 1s, 2s, 3s, 4s;
Đáp án: C
Giải thích: Lớp N là lớp electron thứ 4 nên có 4 phân lớp, được kí hiệu là 4s, 4p, 4d và 4f.
Câu 5. Nguyên tử X có cấu hình electron 1s2 2s2 2p6 3s2 3p4. Khẳng định sai là
A. Nguyên tử X có 16 electron;
B. Phân lớp 3p của nguyên tử X chưa bão hòa;
C. Nguyên tử X có 6 electron ở lớp ngoài cùng;
D. Nguyên tử X có 4 lớp electron.
Đáp án: D
Giải thích:
Tổng số electron trên các phân lớp là 2 + 2 + 6 + 2 + 4 = 16 (electron) nên nguyên tử X có 16 electron. → Khẳng định A đúng
Phân lớp 3p có 4 electron chưa đủ số electron tối đa (6 electron) nên phân lớp 3p chưa bão hòa. → Khẳng định B đúng
Lớp ngoài cùng là lớp thứ 3 có tổng số electron là 2 + 4 = 6 (electron) nên nguyên tử X có 6 electron ở lớp ngoài cùng. → Khẳng định C đúng
Lớp ngoài cùng là lớp thứ 3 nên nguyên tử X có 3 lớp electron. → Khẳng định D sai.
Câu 6. Các electron trong lớp vỏ nguyên tử được phân bố vào các lớp và phân lớp dựa theo
A. năng lượng;
B. khối lượng;
C. kích thước;
D. thể tích.
Đáp án: A
Giải thích:
Các electron trong lớp vỏ nguyên tử được phân bố vào các lớp và phân lớp dựa theo năng lượng của chúng.
Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
Các electron thuộc cùng một phân lớp có năng lượng bằng nhau.
Câu 7. Khẳng định nào sau đây là đúng?
A. Các electron thuộc cùng một lớp có năng lượng bằng nhau, thuộc cùng một phân lớp có năng lượng gần bằng nhau;
B. Các electron thuộc cùng một lớp có năng lượng gần bằng nhau, thuộc cùng một phân lớp có năng lượng bằng nhau;
C. Các electron thuộc cùng một lớp, phân lớp đều có mức năng lượng bằng nhau;
D. Các electron thuộc cùng một lớp, phân lớp có mức năng lượng gần bằng nhau.
Đáp án: B
Giải thích:
Khẳng định đúng là:
Các electron thuộc cùng một lớp có năng lượng gần bằng nhau, thuộc cùng một phân lớp có năng lượng bằng nhau;
Câu 8. Số lượng AO trong lớp electron thứ n (n ≤ 4) là
A. 2n2
B. n2
C. 2n
D. 2n
Đáp án: B
Giải thích:
Trong lớp electron thứ n (n ≤ 4) có:
- Số AO là: n2
- Số electron tối đa là: 2n2
Câu 9. Ở lớp N có số AO là
A. 1;
B. 4;
C. 8;
D. 16.
Đáp án: D
Giải thích:
Trong lớp electron thứ n (n ≤ 4) có n2AO.
Lớp N là lớp thứ 4 nên có 42 = 16 (AO)
Câu 10. Số lượng AO trong các phân lớp ns; np; nd; nf lần lượt là
A. 1; 4; 9; 16
B. 1; 2; 3; 4
C. 1; 3; 5; 7
D. 2; 6; 10; 14
Đáp án: C
Giải thích:
Số lượng AO trong mỗi phân lớp
- Phân lớp ns có 1 AO;
- Phân lớp np có 3 AO;
- Phân lớp nd có 5 AO;
- Phân lớp ns có 7 AO;
Câu 11. Cho nguyên tử Mn có Z = 25. Cấu hình electron của nguyên tử Mn là
A. 1s2 2s2 2p6 3s2 3p6 3d7
B. 1s2 2s2 2p6 3s2 3p6 4d7
C. 1s2 2s2 2p6 3s2 3p6 4s2 3d5
D. 1s2 2s2 2p6 3s2 3p6 3d5 4s2
Đáp án: D
Giải thích:
Nguyên tử Mn có Z = 25.
Điền 25 electron vào dãy Klechkovski theo quy tắc ta được dãy:
1s2 2s2 2p6 3s2 3p6 4s2 3d5
Sắp xếp lại vị trí của phân lớp 4s2 và 3d5 theo quy tắc ta được cấu hình electron là:
1s2 2s2 2p6 3s2 3p6 3d5 4s2
Câu 12. Nguyên tử N có Z = 7. Số electron độc thân trong nguyên tử N là
A. 7
B. 5
C. 3
D. 1
Đáp án: C
Giải thích:
Cấu hình electron nguyên tử của N là: 1s2 2s2 2p3
Cấu hình theo ô orbital của N là:
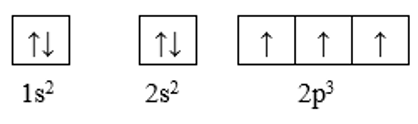
Như vậy nguyên tử N có 3 electron độc thân thuộc AO 2p.
Câu 13. Cho các phát biểu sau
(a) Orbital 1s có dạng hình cầu, orbital 2s có dạng hình số tám nổi;
(b) Trong một nguyên tử, năng lượng của electron thuộc AO 1s thấp hơn năng lượng của electron thuộc AO 2s;
(c) Trong một nguyên tử, năng lượng của electron thuộc AO 2s thấp hơn năng lượng của electron thuộc AO 2p;
(d) Trong một nguyên tử, năng lượng của electron thuộc AO 2s gần bằng năng lượng của electron thuộc AO 2p;
Những phát biểu đúng là
A. (a), (d)
B. (b), (c)
C. (b), (d)
D. (a), (c)
Đáp án: C
Giải thích:
(a) Orbital 1s có dạng hình cầu, orbital 2s có dạng hình số tám nổi ⇒ Sai vì orbital 2s có dạng hình cầu.
(b) Trong một nguyên tử, năng lượng của electron thuộc AO 1s thấp hơn năng lượng của electron thuộc AO 2s ⇒ Đúng vì electron thuộc AO 1s ở lớp thứ nhất gần hạt nhân hơn so với electron thuộc AO 2s ở lớp thứ hai nên có mức năng lượng thấp hơn.
(c) Trong một nguyên tử, năng lượng của electron thuộc AO 2s thấp hơn năng lượng của electron thuộc AO 2p ⇒ Sai vì electron thuộc AO 2s và 2p thuộc cùng lớp thứ 2 mà các electron trong cùng một lớp có mức năng lượng gần bằng nhau.
(d) Trong một nguyên tử, năng lượng của electron thuộc AO 2s gần bằng năng lượng của electron thuộc AO 2p ⇒ Đúng.
Câu 14. Cho nguyên tử Ca có Z = 20. Nguyên tử Ca nhường 2 electron để trở thành ion Ca2+. Biết cấu hình electron của ion được thiết lập bằng cách nhận hoặc nhường electron bắt đầu từ phân lớp ngoài cùng của cấu hình electron nguyên tử tương ứng.
A. 1s2 2s2 2p6 3s2 3p6 4s2
B. 1s2 2s2 2p6 3s2 3p6 4s2 4p2
C. 1s2 2s2 2p6 3s2 3p6
D. 2s2 2p6 3s2 3p6 4s2
Đáp án: C
Giải thích:
Cấu hình electron nguyên tử của Ca có Z = 20 là: 1s2 2s2 2p6 3s2 3p6 4s2
Để trở thành ion Ca2+ nguyên tử Ca nhường 2 electron ở phân lớp ngoài cùng là phân lớp 4s2.
Do đó cấu hình electron của ion Ca2+ là: 1s2 2s2 2p6 3s2 3p6
Câu 15. Tính chất hóa học đặc trưng của nguyên tử được quyết định bởi các electron lớp ngoài cùng. Các nguyên tử có 1, 2 hoặc 3 electron ở lớp ngoài cùng thường là
A. các nguyên tử của nguyên tố phi kim;
B. các nguyên tử của nguyên tố kim loại;
C. các nguyên tử của nguyên tố khí hiếm;
D. các nguyên tử của nguyên tố thuộc nhóm halogen.
Đáp án: B
Giải thích:
Tính chất hóa học đặc trưng của nguyên tử được quyết định bởi các electron lớp ngoài cùng. Từ cấu hình electron nguyên tử ta có thể dự đoán được tính chất theo quy tắc:
- Các nguyên tử có 1, 2 hoặc 3 electron ở lớp ngoài cùng thường là các nguyên tử của nguyên tố kim loại.
- Các nguyên tử có 5, 6 hoặc 7 electron ở lớp ngoài cùng thường là các nguyên tử của nguyên tố phi kim.
- Các nguyên tử có 8 electron ở lớp ngoài cùng (trừ He chỉ có 2 electron) là các nguyên tử của nguyên tố khí hiếm.
- Các nguyên tử có 4 electron ở lớp ngoài cùng thì có thể là nguyên tử của nguyên tố kim loại hoặc phi kim.
Phần 2: Lý thuyết Lớp, phân lớp và cấu hình electron
I. Lớp và phân lớp electron
Các electron trong lớp vỏ nguyên tử được phân bố vào các lớp và phân lớp dựa theo năng lượng của chúng.
1. Lớp electron
- Các electron thuộc cùng một lớp có năng lượng gần bằng nhau.
- Trong mỗi lớp electron, có thể có một hoặc nhiều AO.
Bảng 5.1. Số lượng AO và số electron tối đa trong mỗi lớp
|
Lớp |
K (n = 1) |
L (n = 2) |
M (n = 3) |
N (n = 4) |
|
Số lượng AO |
1 |
4 |
9 |
16 |
|
Số electron tối đa |
2 |
8 |
18 |
32 |
- Số electron và số lượng AO trong lớp thứ n (n £ 4) được ghi nhớ theo quy tắc sau:
+ Lớp thứ n có n2 AO.
+ Lớp thứ n có tối đa 2n2 electron.
Ví dụ: Dựa vào công thức này tính được lớp thứ tư (lớp N, n = 4) có 42 = 16 AO và chứa tối đa 2.42 = 32 electron.
Lưu ý: Năng lượng của một electron phụ thuộc vào khoảng cách từ electron đó tới hạt nhân. Electron càng xa hạt nhân thì có năng lượng càng cao.
Ví dụ: Các lớp electron xếp theo thứ tự mức năng lượng từ thấp đến cao: K, L, M, N ..
2. Phân lớp electron
- Mỗi lớp electron (trừ lớp thứ nhất) lại được chia thành các phân lớp theo nguyên tắc: Các electron thuộc cùng một phân lớp có năng lượng bằng nhau.
- Số lượng và kí hiệu các phân lớp trong một lớp: Lớp electron thứ n có n phân lớp và được kí hiệu lần lượt là ns, np, nd, nf, ... Cụ thể:
+ Lớp K (n =1): có 1 phân lớp, được kí hiệu là 1s.
+ Lớp L (n =2): có 2 phân lớp, được kí hiệu là 2s và 2p.
+ Lớp M (n =3): có 3 phân lớp, được kí hiệu là 3s, 3p và 3d.
- Số lượng AO trong mỗi phân lớp
+ Phân lớp ns chỉ có 1 AO.
+ Phân lớp np có 3 AO.
+ Phân lớp nd có 5 AO.
+ Phân lớp nf có 7 AO.
- Số electron trong mỗi phân lớp được biểu diễn bằng chỉ số phía trên, bên phải kí hiệu phân lớp. Phân lớp nào đã có tối đa electron được gọi là phân lớp bão hòa.
Ví dụ: Kí hiệu 1s2 cho biết phân lớp 1s có 2 electron. Do phân lớp 1s chỉ có 1 AO nên phân lớp 1s chứa tối đa 2 electron, 1s2 được gọi là phân lớp bão hòa.
Lưu ý: Số lượng electron tối đa trong mỗi phân lớp
- Phân lớp ns chứa tối đa 2 electron.
- Phân lớp np chứa tối đa 6 electron.
- Phân lớp nd chứa tối đa 10 electron.
- Phân lớp nf chứa tối đa 14 electron.
II. Cấu hình electron nguyên tử
1. Cách viết cấu hình electron nguyên tử
- Cấu hình electron biểu diễn sự phân bố electron vào lớp vỏ nguyên tử theo các lớp và phân lớp.
- Các bước viết cấu hình electron nguyên tử theo những nguyên tắc sau:
+ Quy tắc 1: Điền electron theo thứ tự các mức năng lượng từ thấp đến cao (dãy Klechkovski):
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s...
Điền electron bão hòa phân lớp trước rồi mới điền tiếp vào phân lớp sau.
- Quy tắc 2: Đổi lại vị trí các phân lớp sao cho số thứ tự lớp (n) tăng dần từ trái qua phải, các phân lớp trong cùng một lớp theo thứ tự s, p, d, f.
Ví dụ: Nguyên tử Fe có Z = 26, sau khi điền electron vào dãy Klechkovski nhận được dãy 1s22s22p63s23p64s23d6. Sắp xếp lại vị trí phân lớp 4s2 và 3d6 thu được cấu hình electron là 1s22s22p63s23p63d64s2.
- Cấu hình electron cho biết thứ tự mức năng lượng các electron giữa các phân lớp. Năng lượng của electron trong mỗi phân lớp tăng theo chiều từ trái qua phải.
Ví dụ: Cấu hình electron nguyên tử của oxygen là 1s22s22p4. Trong nguyên tử oxygen, năng lượng của electron thuộc phân lớp 2s cao hơn electron thuộc phân lớp 1s, năng lượng của electron thuộc phân lớp 2p cao hơn electron thuộc phân lớp 2s.
Lưu ý: Quy tắc đường chéo xác định dãy Klechkovski như sau:
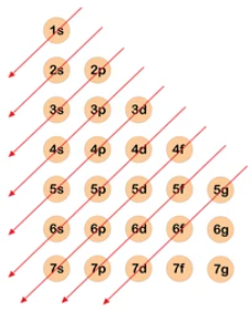
Hình 5.1. Quy tắc đường chéo xác định dãy Klechkovski
2. Biểu diễn cấu hình electron theo ô orbital
- Biểu diễn cấu hình electron theo orbital (còn gọi là cách biểu diễn cấu hình theo ô lượng tử) là một cách biểu diễn sự phân bố electron theo orbital, từ đó biết được nguyên tử có bao nhiêu electron độc thân, electron độc thân đó nằm ở orbital nào.
- Quy tắc biểu diễn cấu hình electron theo orbital:
+ Quy tắc 1: Viết cấu hình electron của nguyên tử
+ Quy tắc 2: Biểu diễn mỗi AO bằng một ô vuông (orbital hay ô lượng tử), các AO trong cùng phân lớp thì viết liền nhau, các AO khác phân lớp thì viết tách nhau. Thứ tự các ô orbital từ trái sang phải theo thứ tự như ở cấu hình electron.
+ Quy tắc 3: Điền electron vào từng ô orbital theo thứ tự lớp và phân lớp, mỗi electron biểu diễn bằng một mũi tên.
Lưu ý:
- Trong mỗi phân lớp, electron được phân bố sao cho số electron độc thân là lớn nhất, electron được điền vào các orbital theo thứ tự từ trái sang phải.
- Trong một ô orbital, electron đầu tiên được biểu diễn bằng mũi tên quay lên, electron thứ hai được biểu diễn bằng mũi tên quay xuống.
Ví dụ:
+ Nguyên tử O (Z = 8) có cấu hình electron nguyên tử là 1s22s22p4.
+ Cấu hình theo orbital của O như sau:
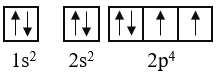
Như vậy, nguyên tử oxygen có 2 elctron độc thân, thuộc AO 2p.
Mở rộng: Electron mang điện tích âm nên hai electron trong cùng một AO sẽ đẩy nhau, vì vậy chúng có xu hướng tách nhau ra và chiếm hai AO khác nhau. Đây là lí do vì sao trong một phân lớp, các electron cần được sắp xếp sao cho số electron độc thân là lớn nhất.
III. Dự đoán tính chất hóa học cơ bản của nguyên tố dựa theo cấu hình electron của nguyên tử
Các electron thuộc lớp ngoài cùng có vai trò quyết định đến tính chất hóa học đặc trưng của nguyên tố (tính kim loại, tính phi kim, tính trơ, ...). Từ cấu hình electron có thể dự đoán các tính chất này theo quy tắc sau:
- Quy tắc 1: Các nguyên tử có 1, 2 hoặc 3 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố kim loại. Tính kim loại thể hiện qua khả năng nhường electron trong các phản ứng hóa học (tính khử).
Ví dụ: Nguyên tử Na (Z =11) có 1 electron ở lớp ngoài cùng nên Na là nguyên tố kim loại.
- Quy tắc 2: Các nguyên tử có 5, 6 hoặc 7 electron ở lớp ngoài cùng thường là các nguyên tử nguyên tố phi kim. Tính phi kim thể hiện qua khả năng nhận electron trong các phản ứng hóa học (tính oxi hóa).
Ví dụ: Nguyên tử O (Z = 8) có 6 electron ở lớp ngoài cùng nên O là nguyên tố phi kim.
- Quy tắc 3: Các nguyên tử có 8 electron ở lớp ngoài cùng (trừ He chỉ có 2 electron) là các nguyên tử nguyên tố khí hiếm. Các nguyên tố này rất khó tham gia các phản ứng hóa học (tính trơ).
Ví dụ: Nguyên tử Ne (Z = 10) có 8 electron ở lớp ngoài cùng nên Ne là nguyên tố khí hiếm.
- Quy tắc 4: Nếu lớp electron ngoài cùng của một nguyên tử có 4 electron thì nguyên tử nguyên tố đó có thể là kim loại hoặc phi kim.
Xem thêm các bài trắc nghiệm Hóa học 10 Cánh diều hay, chi tiết khác:
Trắc nghiệm Hóa 10 Bài 4: Mô hình nguyên tử và orbital nguyên tử
Trắc nghiệm Hóa 10 Bài 5: Lớp, phân lớp và cấu hình electron
Trắc nghiệm Hóa 10 Bài 6: Cấu tạo của bảng tuần hoàn các nguyên tố hóa học
Trắc nghiệm Hóa 10 Bài 8: Định luật tuần hoàn và ý nghĩa của bảng tuần hoàn các nguyên tố hóa học